The Lancet综述 | 晚期非小细胞肺癌治疗的前景及挑战
肺癌是全球癌症相关死亡的主要原因。靶向疗法和免疫疗法极大地改善了晚期非小细胞肺癌 (NSCLC) 患者的临床治疗,比如针对致癌驱动突变的酪氨酸激酶抑制剂不断升级以提高有效性并解决耐药性问题,抗体-药物偶联物和双特异性抗体目前正被纳入治疗指南,包括T细胞接合剂 (T cell engager, TCE) 、癌症疫苗等在内的新兴疗法也正在迅速发展。尽管在NSCLC的治疗上取得了一些进展,但在识别预测生物标志物以实现个体化治疗、消除耐药性等方面仍然存在挑战。
近日,来自西奈山Tisch癌症研究所的 Fred R Hirsch 团队在 The Lancet 杂志上发表了一篇题为 New promises and challenges in the treatment of advanced non-small-cell lung cancer 的综述,他们 详细介绍并讨论了晚期NSCLC(IV期)的治疗进展、前景及局限性 ,我们将在下文对文中内容进行简要概述。
亚欧人群在NSCLC中的致癌驱动基因改变方面存在显著差异,由于不同突变对应特定的治疗策略,识别突变的工作就显得尤为重要。
亚洲NSCLC人群的EGFR突变率较高,主要包括4种类型:外显子19缺失突变、外显子21和18点突变和外显子20插入突变,其中,外显子19缺失突变和外显子21的Leu858Arg突变为经典突变,约占全部EGFR突变的90%。对于此类突变,奥希替尼 (osimertinib) 是标准的一线治疗,与奥希替尼单一疗法相比,该药与化疗或与阿米万他单抗 (一种针对EGFR和c-MET的双特异性抗体) 与拉泽替尼 (第三代EGFR TKI,即酪氨酸激酶抑制剂) 的两种联合疗法的3期试验显示出患者的无进展生存期有所改善,但生存数据仍有待确定。而非经典EGFR突变会改变EGFR蛋白构象,因此,相较于经典突变,对TKI反应较弱。Sunvozertinib是一种针对非经典EGFR外显子20插入突变的TKI,已在中国获批,其他针对该类突变的药物如zipalertinib (NCT05973773) 和poziotinib (NCT03066206) 正在研究中,尽管初始反应率很高,但终会产生耐药性,因而对耐药机制的更深入理解将有助于提高治疗效果。
KRAS基因突变存在于25%的白人NSCLC患者中,其中,KRAS Gly12Cys突变最为常见。截至目前,两种KRAS Gly12Cys抑制剂sotorasib和adagrasib已被批准用于二线治疗,其他新型KRAS Gly12Cys抑制剂如JDQ443 (NCT05132075) 和 LY3537982 (NCT06119581) 以及针对非Gly12Cys突变的临床试验 (NCT05737706和NCT05379985) 正在开展。文中除了阐述针对EGFR和KRAS致癌驱动突变的靶向治疗进展外,还列举了其他NSCLC驱动基因如ROS1、ALK等相关药物的研究进展,扩大了潜在的可治疗NSCLC患者范围。
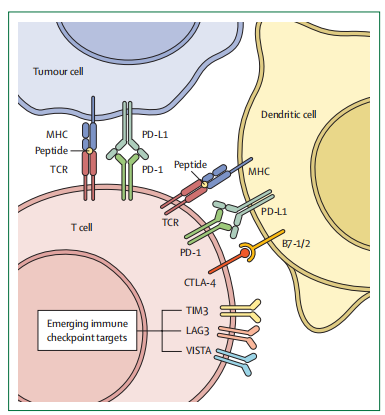
免疫检查点抑制剂 (ICIs) 以CTLA4或PD-L1通路为靶点,已被证明可显着提高无靶向突变或携带KRAS致癌突变的晚期NSCLC患者生存率和长期疾病控制。然而,ICIs可能会引起严重的副作用,如肺炎或结肠炎,且费用较高,因此确定哪些患者将从中受益至关重要。截至目前,已发现多种耐药机制,包括由于表观遗传和转录后沉默而导致的新抗原识别减少、抗原呈递改变、PD-L1和新抗原表达丧失以及T细胞排斥,提示癌症免疫疗法的复杂性和动态性。
根据癌细胞上PD-L1的表达情况将患者分为三层:高 (>50%) 、中 (1-49%) 和低 (<1%) 。对于高PD-L1患者,抗PD-1和抗PD-L1单独使用或与化疗联合使用的优势已得到充分证实。一项临床3期试验 (NCT04547504 )正在进行中,旨在比较派姆单抗单独或与铂类联合疗法在改善患者中位生存期方面的作用。对于中等PD-L1表达的NSCLC患者,抗PD-1或抗PD-L1 ICI与化疗相结合是标准治疗方法,两项3期试验结果表明,与单独化疗相比,双重ICIs (抗 PD-1或抗PD-L1和抗CTLA4) 加化疗均能改善显著改善无进展生存期。而对于PD-L1表达低于1%的NSCLC患者,抗PD-1或抗PD-L1的活性较低,两者与化疗的组合或在PD-L1阻断中添加抗 CTLA4 抑制剂已显示出生存率的改善。
然而,抗PD-1和抗PD-L1 ICI在EGFR突变NSCLC中的疗效仍未得到证实,因为试验表明在化疗中添加派姆单抗、纳武单抗等没有任何益处,但一项纳入了具有EGFR或ALK突变的NSCLC 患者的3期IMpower150试验表明ICI与抗VEGF疗法和化疗相结合时具有一定的疗效。此外,还有部分研究表明ICI对携带与吸烟相关致癌突变 (如MET外显子14和BRAFV600E突变) 的患者具有潜在益处。
在考虑二线治疗时,根据患者之前接触ICI的情况,采取的方法也有所不同。对于既往未接触过ICI的患者,建议使用抗PD-1或抗PD-L1治疗,对于接受过的患者,多采用多西他赛 (联合或不联合抗VEGFR2的雷莫芦单抗) 。在ICI治疗期间或治疗后不久 (3-6 个月内) 出现疾病进展后,通常不建议开始另一轮 ICI 单药治疗,而对于最初对ICI有反应但已停止治疗很长一段时间 (例如超过6个月) 的患者,可以考虑重新接受治疗。
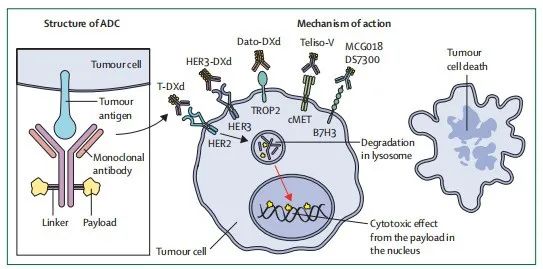
NSCLC中的ADC开发仍处于早期阶段,这一疗法主要在后期治疗中进行测试,且迄今为止仅推荐用于治疗一线治疗后进展的晚期HER2突变型NSCLC,但由于尚未建立可靠的生物标志物,难以确定能从ADC中受益的患者群体特征。对于HER2突变型NSCLC患者,已有两种ADC被纳入二线治疗指南,分别是曲妥珠单抗-emtansine和曲妥珠单抗-deruxtecan,这两种ADC在约一半接受治疗的患者中显示出抗肿瘤反应,一项3期试验正在进行中,以研究曲妥珠单抗-deruxtecan作为一线治疗 (NCT05048797) 的潜能。对于 EGFR 突变 NSCLC 患者,patritumab-deruxtecan旨在靶向HER3并解决EGFR TKI耐药性,在接受EGFR TKI (包括奥希替尼) 治疗后进展的NSCLC患者中,客观缓解率为30%。在一项3期试验中,另一种靶向TROP2的ADC Sacituzumab-govitecan与多西他赛相比,并未改善生存或无进展生存。在CEACAM5高表达的NSCLC患者中,tusamitamab-ravtansine显示出部分活性,但与多西他赛相比,并未显示能改善无进展生存期,目前已停止开发。此外,CD276是一种在多种癌症中发现的跨膜蛋白,DS-7300a和MGC018都是专为靶向CD276设计的ADC,在包括小细胞肺癌在内的早期试验中已显示出良好的抗肿瘤活性。其他几个靶点,如AXL、MAP3K7、NECTIN4、TF、ROR2、GPNMB和SLC34A2目前正在研究中。由于ADC通常使用高效化疗药物,可能会导致严重的副作用如间质性肺炎和血细胞减少症,未来需要进一步完善降低毒性的策略包括优化药物与抗体的比例和剂量调整。
嵌合抗原受体 (CAR) T细胞是一种创新的过继免疫疗法,将淋巴细胞经过基因工程改造以靶向并结合特定的肿瘤抗原,从而定向杀死肿瘤细胞,该策略已被批准用于治疗血液恶性肿瘤,且正在对包括NSCLC在内的各种实体瘤进行研究,但由于复杂的肿瘤微环境、肿瘤相关抗原的异质性和毒性等因素,使得实体瘤的CAR T策略的实施颇具挑战性。
肿瘤浸润淋巴细胞 (TIL) 疗法是一种个体化T细胞工程方法,涉及分离、扩增和回输患者肿瘤中已有的淋巴细胞。这种治疗比CAR T细胞疗法更复杂,但提供了更量身定制的免疫治疗策略。这种方法对转移性黑色素瘤有效,目前正在针对NSCLC进行研究,早期试验已显示出长期反应。需要注意的是,尽管TIL疗法具有潜力,但仍面临障碍,例如成本高、毒性大、程序复杂以及需要更多药物等,未来还需要进行更广泛的临床试验,以充分了解其有效性和安全性。
个性化疫苗旨在利用患者的肿瘤特异性抗原来激活免疫反应,针对ALK重排型NSCLC的疫苗目前已观察到了有治疗潜力的临床前结果。肿瘤治疗场 (TTF) 是一种非侵入性疗法,通过应用于皮肤的可穿戴设备进行管理,可通过破坏微管聚合和解聚,导致有丝分裂中断并最终导致肿瘤细胞死亡。TTF最初是为胶质母细胞瘤开发的,并被批准用于胶质母细胞瘤和间皮瘤,现在正在 NSCLC 中进行研究。在一项3期试验中,对于铂类治疗后病情进展的NSCLC患者,添加TTF可以改善总体生存率。
靶向治疗和免疫治疗的快速发展为NSCLC患者提供了希望,但诸如耐药性发展、治疗毒性、高成本、试验中少数群体代表性不足以及获得诊断和治疗的机会很少等挑战仍然存在。未来应重视联合研究人员和临床医生等共同寻求解决方案以推进NSCLC治疗。
https://doi.org/10.1016/S0140-6736(24)01029-8
制版人:十一
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/08/30/The%20Lancet%E7%BB%BC%E8%BF%B0%20%7C%20%E6%99%9A%E6%9C%9F%E9%9D%9E%E5%B0%8F%E7%BB%86/
THE END






赶快来坐沙发