Immunity:提高T细胞抗肿瘤功能,郑州大学张毅团队揭示磷脂代谢的重要作用
在肿瘤微环境中,免疫细胞的抗肿瘤活性受到葡萄糖、脂质和氨基酸代谢的变化影响。例如,CD8+ T细胞的活化、增殖和细胞因子的分泌都与脂质代谢密切相关。脂质代谢异常时会加剧CD8+ T细胞的衰竭,减损T细胞的抗肿瘤功能。
磷脂 是许多细胞类型中表达丰度较高的一种脂质,在免疫反应中发挥重要功能。 在肿瘤微环境中,CD8+ T细胞的磷脂代谢有哪些变化,又会如何影响CD8+ T细胞的抗肿瘤功能?
围绕这一未知问题,郑州大学生物细胞治疗中心 张毅教授 的研究团队日前在 Immunity 上发表论文,展开了详细解析和探究。相关发现为 将来以T细胞为基础的免疫治疗干预和改造提供了新的视角和靶点 。

研究人员首先分析了来自5名肺癌患者的样本,通过脂质代谢组学发现,相比循环中的CD8+ T细胞,肿瘤浸润CD8+ T细胞的磷脂酰胆碱(PC)和磷脂酰乙醇胺(PE)含量降低。进一步实验显示,介导磷脂酰胆碱和磷脂酰乙醇胺合成的代谢酶 磷脂磷酸酶1(PLPP1) 在肿瘤浸润CD8+ T细胞中显著下调。
利用基因编辑小鼠,研究人员发现缺少 Plpp1 的CD8+ T细胞会增加不饱和磷脂合成代谢,最终导致细胞发生铁死亡,降低其抗肿瘤功能。相反,在嵌合抗原受体T细胞(CAR-T细胞)过表达Plpp1,能够增强CAR-T细胞的磷脂代谢,提高其在体内的抗肿瘤功能。
从机制上来看,该研究发现肿瘤浸润CD8+ T细胞中的PLPP1表达受到抑制是由PD-1信号通过Akt-GATA1通路介导发生的。用PD-1单抗阻断PD-1信号,可增加PLPP1的表达,恢复CD8+ T细胞的抗肿瘤功能。同时,研究还发现 PLPP1表达水平与PD-1单抗治疗疗效正相关 。
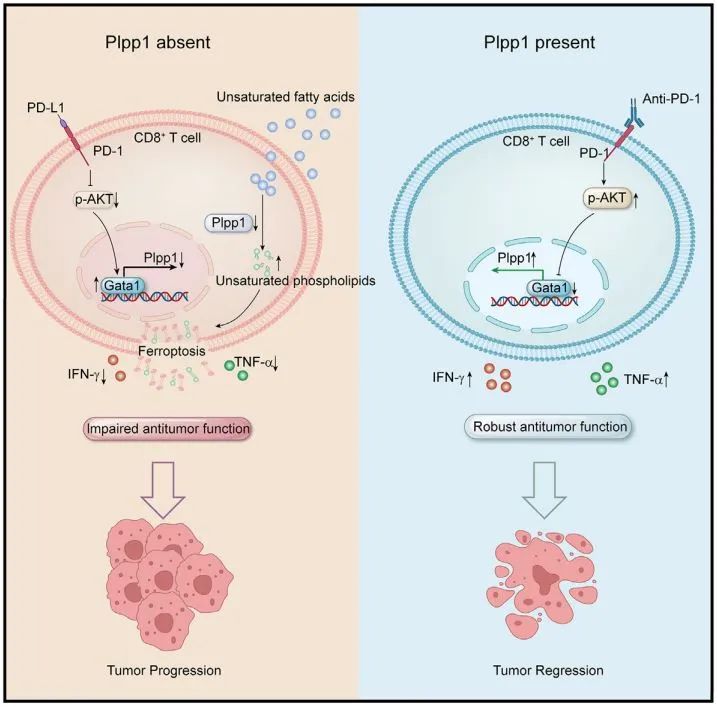
▲ 研究示意图:(左)PD-1通路激活,抑制PLPP1表达,导致T细胞发生铁死亡,抗肿瘤功能降低;(右)PD-1单抗增强了PLPP1表达,提高T细胞抗肿瘤功能(图片来源:参考资料[1])
张毅教授表示, 如何通过改变PLPP1的表达提高免疫治疗效果,是未来研究的主要关注点 。在此次研究中,团队初步发现PLPP1-CAR-T细胞的磷脂合成代谢增强,体内抗肿瘤功能增强,后续将进一步关注PLPP1-CAR-T细胞在不同肿瘤模型中的抗肿瘤功能,进一步优化其结构, 为临床CAR-T细胞治疗提供新的改造方案 。此外,张毅教授团队正在筛选 PLPP1激动剂 ,希望能为提高以PD-1单抗为主的免疫治疗临床疗效提供助力。
郑州大学第一附属医院生物细胞治疗中心主任、生物免疫治疗病区主任张毅教授为本研究的独立通讯作者。郑州大学第一附属医院生物细胞治疗中心助理研究员平玉、生物免疫治疗病区住院医师单吉琦、生物细胞治疗中心博士研究生生秦海名为本研究的第一作者。
参考资料:
[1] Ping et al., PD-1 signaling limits expression of phospholipid phosphatase 1 and promotes intratumoral CD8+ T cell ferroptosis, Immunity (2024), https://doi.org/10.1016/j.immuni.2024.08.003
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/08/30/Immunity%EF%BC%9A%E6%8F%90%E9%AB%98T%E7%BB%86%E8%83%9E%E6%8A%97%E8%82%BF%E7%98%A4%E5%8A%9F%E8%83%BD%EF%BC%8C/
THE END






 知道|国家药品不良反应监测年度报告(2024年)
知道|国家药品不良反应监测年度报告(2024年)
赶快来坐沙发