Genome Biol丨空间多组学揭示了人类肝细胞癌中与癌症干细胞相关的成纤维细胞亚群
近日,国际学术期刊 Genome Medicine 在线发表了中国科学院上海营养与健康研究所 李虹 研究组与海军军医大学国家肝癌科学中心/附属东方肝胆外科医院 贺宇飞/王红阳/陈磊 团队合作的研究文章 Spatial multiomics reveals a subpopulation of fibroblasts associated with cancer stemness in human hepatocellular carcinoma 。该研究 利用空间多组学分析表征了肝癌微环境中的肿瘤基质,进一步发现了一类成纤维细胞群体,其与肝癌干细胞在肿瘤内共定位,并在体外培养中可以促进HCC细胞的增殖和干性 。
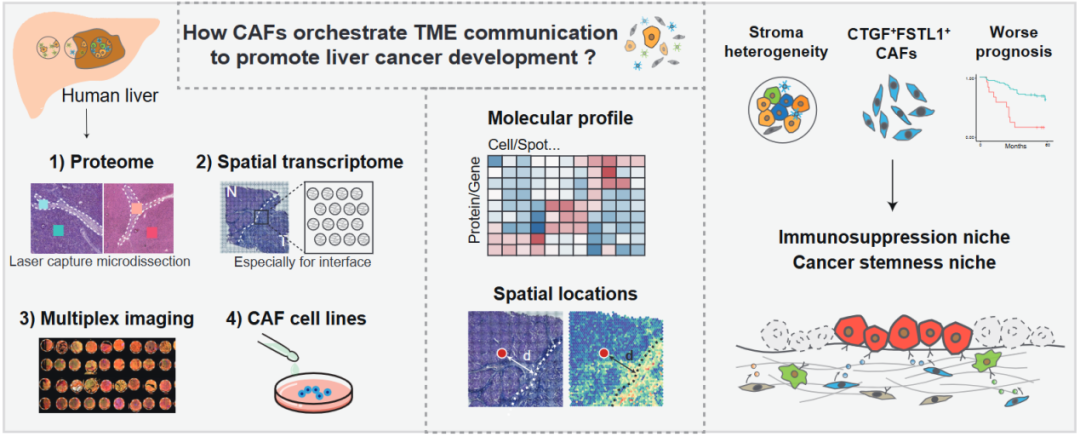
癌症发生的本质是“土壤” (即肿瘤微环境;tumor microenvironment, TME) 支持“种子” (即癌症干细胞;cancer stem cell, CSC) 生长的过程,癌症相关成纤维细胞 (cancer-associated fibroblast, CAF) 是TME中的主要细胞类型。尽管单细胞RNA测序 (scRNA-seq) 提供了关于CAF多样性的重要信息,但空间技术的出现彻底改变了TME领域,并更直观地揭示了多种组分的协调机制。在很多癌症类型中已经探索了CAFs与其他细胞的接近性;然而,某些CAF表型的精确空间邻域以及通过这种空间关系发生的功能变化以支持CSC的机制仍不清楚。
该工作结合多区域蛋白质组学、10X Genomics Visium空间转录组学和多通道成像等前沿空间技术来破译成纤维细胞在原发性肝癌病人中的表达异质性、功能多样性,以及在TME中的空间分布、多细胞群体的共定位和细胞间通讯。特别的,本工作结合空间转录组数据和单细胞测序数据,鉴定出一个肝脏CAF亚群,其高表达 CTGF 、 FSTL1 、 COL1A2 、 COL4A1 、 COL4A2 ,命名为F5-CAF。该亚群更倾向于分布在肿瘤巢内或与癌旁交界区域,并与高干性特征的肝癌细胞存在显著的共定位现象。NOTCH和TGFB通路可能是干性维持的潜在机制。在另两套独立的肝癌大队列中,F5-CAF的细胞丰度与病人较差的预后相关。进一步的体外实验表明,从HCC患者中分离出的F5-CAF可以促进肝癌细胞的增殖和干性。本研究表明肝癌TME中的CAF亚群可能通过支持CSC的存活来促进肝癌发展,为癌症发生的“种子-土壤”理论提供了依据。
中国科学院上海营养与健康研究所博士生荆思雨,海军军医大学国家肝癌科学中心/附属东方肝胆外科医院博士生刘丹 (已毕业) 、冯娜和董辉为该论文的共同第一作者。海军军医大学国家肝癌科学中心贺宇飞研究员,中国科学院上海营养与健康研究所李虹研究员,海军军医大学国家肝癌科学中心/附属东方肝胆外科医院王红阳院士和陈磊研究员为该论文的共同通讯作者。
https://genomemedicine.biomedcentral.com/articles/10.1186/s13073-024-01367-8
制版人:十一
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/08/30/Genome%20Biol%E4%B8%A8%E7%A9%BA%E9%97%B4%E5%A4%9A%E7%BB%84%E5%AD%A6%E6%8F%AD%E7%A4%BA%E4%BA%86/
THE END






赶快来坐沙发