Cell Death Differ丨郑红团队发现FOXO在维持CCKBR+的干细胞样胃腺癌细胞中的关键作用
胃腺癌占所有胃癌的90%-95%,术后复发及死亡率仍然很高。目前对于胃腺癌的发病机制仍知之甚少,主要原因是因为胃腺癌的细胞来源不清楚,肿瘤的主要细胞成分存在很大的异质性 【1】 。胃窦腺体主要分为小凹细胞,壁细胞,基底部干细胞库和转化+4干细胞。关于已分化的小凹细胞或肠化生类型的胃腺癌已经被广泛研究,但干细胞相关胃腺癌未被广泛认知 【2】 。干细胞由于具有长期存活能力更容易积累更多的致癌突变,特定基因突变会诱导干细胞发生恶性转化,从而导致胃腺癌的发生 【3】 。但不同类型干细胞恶性转化后形成的胃腺癌在临床病人中的异质性尚未进行深入探讨,因此探究此机制将对胃腺癌的临床治疗提供全新思路。
近日,安徽医科大学 郑红 团队在 Cell Death & Differentiation 杂志上在线发表了题为 CCKBR+ cancer cells contribute to the intratumor heterogeneity of gastric cancer and confer sensitivity to FOXO inhibition 的研究论文, 揭示了CCKBR+的胃腺癌细胞具有干细胞样潜能,具有独特的基因突变景观,与胃腺癌病人低生存率及预后差密切相关,并发现FOXO是维持CCKBR+的胃腺癌细胞干性的关键因素。
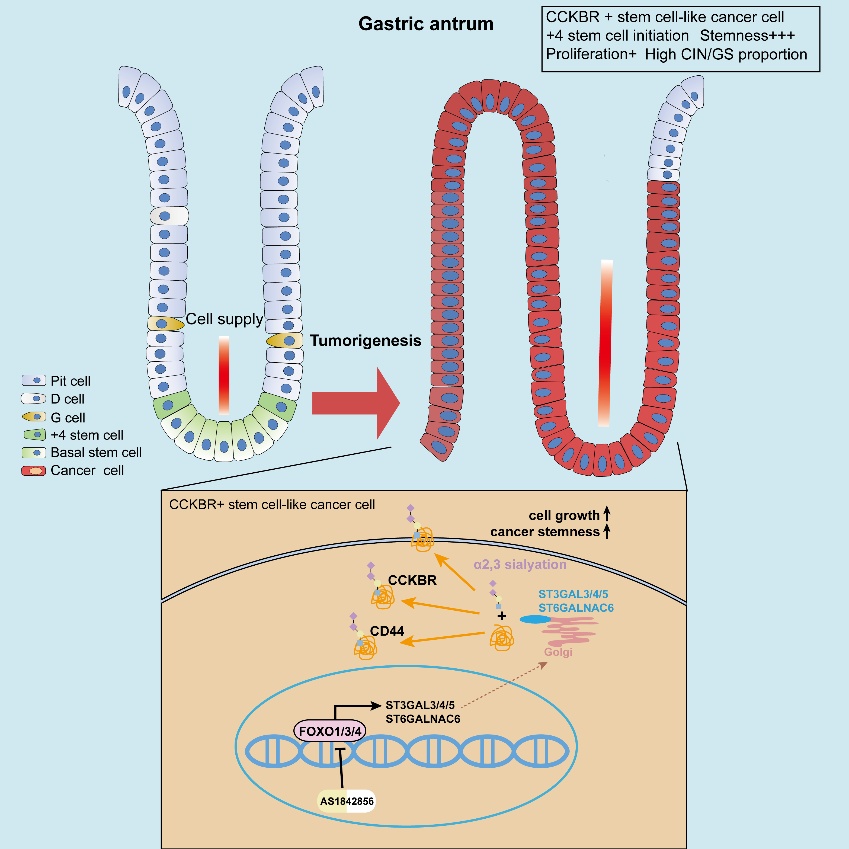
研究人员首先利用胃腺癌组织进行单细胞RNA测序发现并鉴定了CCKBR+的干细胞样肿瘤细胞,并通过一系列标志物marker鉴定证实其属于具有胃窦+4干细胞特征的肿瘤细胞。为了进一步确定这种干细胞样肿瘤细胞是否是由肿瘤细胞去分化形成的,作者进行了CNV聚类等分析以确定CCKBR+细胞是原始的、且是+4干细胞起源的低分化干细胞样肿瘤细胞。接下来研究人员进行了大量的临床病理检测,确定了CCKBR+的肿瘤以低分化胃窦肿瘤为主,并且较高的CCKBR+肿瘤细胞浸润和病人较差的生存率和治疗预后相关。作者进一步用外源的40个样本来源的胃腺癌单细胞RNA转录组库对这些结果进行了进一步验证。
为了探究CCKBR+的肿瘤形成是否是由特定基因突变引起的,作者利用TCGA数据库富集CCKBR+的肿瘤进行了基因突变分析。相对于CCKBR-的肿瘤,CCKBR+的肿瘤具有更高的CIN和GS类型肿瘤比例,提示其具有不同的突变特征。突变基因筛查和肿瘤驱动基因分析揭示CCKBR+的肿瘤具有更低的突变频率,并主要由TP53,APC,SMAD4和GLI3基因突变驱动,进一步MSI评分,TMB评分和基因表达分析显示CCKBR+的肿瘤与CCKBR-的肿瘤无关,属于独立生存的肿瘤,并且特定的基因突变不是形成CCKBR+的肿瘤的唯一因素。
研究者在接下来的机制探讨中发现CCKBR+的肿瘤表现出较高的FOXO活化状态。转录组学分析和免疫组化检测确定了FOXO1/3/4和CCKBR表达的相关性,提示FOXO1/3/4可能参与CCKBR+的胃腺癌细胞的稳态维持。进一步利用胃腺癌细胞系和小鼠异位瘤模型,通过肿瘤成球实验和极限稀释实验确定FOXO和CCKBR参与肿瘤干细胞形成。而给予FOXO抑制剂AS1842856可以抑制CCKBR的表达和肿瘤球的形成。
为了深入验证以上机制,作者建立了临床CCKBR阳性和CCKBR阴性的类器官,给予FOXO抑制剂AS1842856并结合临床化疗药物,通过类器官生长实验检测、凋亡实验检测及裸鼠成瘤实验确定其对CCKBR+的胃腺癌的抑制作用,同时联合AS1842856和化疗药5-FU可以发挥更有效抑制肿瘤生长的作用。以上结果确定了抑制FOXO对于CCKBR+的肿瘤生长的影响。最终CUT&Tag分析和Lectin pulldown实验阐明FOXO通过调控CCKBR+细胞的α2,3唾液酸化水平发挥肿瘤干性调节功能。
FOXOs调控α2,3唾液酸转移酶维持CCKBR阳性的胃腺癌干细胞稳态
综上所述, 本研究发现CCKBR+的干细胞样胃腺癌细胞,并确定FOXO通过调控α2,3唾液酸转移酶调节CD44和CCKBR的α2,3唾液酸化水平,来维持CCKBR阳性的胃腺癌干细胞稳态,FOXO可能是抑制CCKBR阳性的干细胞样肿瘤的潜在治疗靶点。
安徽医科大学的郑红教授和阚晨副教授,中南大学湘雅二医院段伦喜为该论文的通讯作者,其团队的谭振亚博士为该论文的第一作者,潘可博士、孙敏琼博士为共同第一作者。
原文链接:
https://www.nature.com/articles/s41418-024-01360-z
制版人:十一
1. Hayakawa, Y., et al., Stem cells and origins of cancer in the upper gastrointestinal tract. Cell Stem Cell , 2021. 28(8): p. 1343-1361.
2. Kumar, V., et al., Single-Cell Atlas of Lineage States, Tumor Microenvironment, and Subtype-Specific Expression Programs in Gastric Cancer. Cancer Discov , 2022. 12(3): p. 670-691.
3. Tan, S.H., et al., AQP5 enriches for stem cells and cancer origins in the distal stomach. Nature , 2020. 578(7795): p. 437-443.
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/08/30/Cell%20Death%20Differ%E4%B8%A8%E9%83%91%E7%BA%A2/
THE END