巧用国自然热点,解锁肿瘤转移新视角
近年来,巨噬细胞、线粒体、炎症、自噬、干细胞和外泌体相关的研究热度持续攀升,胞葬已经成为国自然关注的重要热点之一。此外,肿瘤的发生、发展及转移也始终是研究的重点。今天,让我们一同探讨, 如何利用国自然热点,解锁肿瘤转移研究新视角!

2024年2月,利物浦大学 Michael C Schmid团队在《Nature Cancer》 (IF:23.5)发表了题为“ Efferocytosis reprograms the tumor microenvironment to promote pancreatic cancer liver metastasis ”的研究论文。研究发现,在胰腺导管腺癌(PDAC)肝转移过程中,胞葬作用引发的巨噬细胞重编程促使其向免疫抑制性表型转变,进而促进肿瘤的转移生长。
1.巨噬细胞的多样性: 在转移肝脏中发现了多种巨噬细胞亚群,这些亚群表现出不同的基因表达特征。其中,一些亚群具有抗原呈递能力,而另一些则表现出免疫抑制或增殖特性。
2.免疫抑制性巨噬细胞: 在早期肝转移中,CD74低表达的巨噬细胞表现出强大的免疫抑制功能,并且这种免疫抑制性与凋亡细胞清除过程密切相关。
3.胞葬作用的抑制: 通过抑制巨噬细胞中的胞葬作用,显著减少了免疫抑制性巨噬细胞的数量,增强了CD8+ T细胞的功能,并减少了肝转移的发生。
4.颗粒蛋白前体的作用: 颗粒蛋白前体在巨噬细胞胞葬作用后升高,并调节溶酶体酸化过程。敲除巨噬细胞中的颗粒蛋白前体可以减少免疫抑制性巨噬细胞的形成,抑制肝转移。
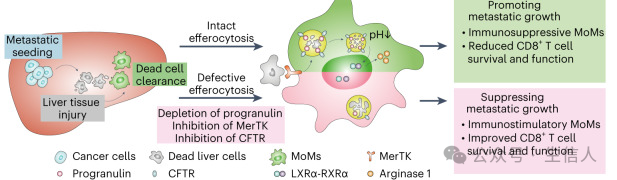
胰腺导管腺癌(PDAC)是一种高度转移性疾病,预后差。肝转移是患者死亡的主要原因。巨噬细胞在PDAC肝转移中积累,并表现出免疫抑制特性,促进肿瘤生长,削弱免疫治疗的效果。
对来自PDAC患者的肝转移样本,采用RNA-seq和scRNA-seq技术,分析了不同阶段转移灶中的巨噬细胞亚群。通过基因敲除小鼠模型和药理学手段,研究了胞葬作用对巨噬细胞免疫表型和肝转移发展的影响。此外,还进行了骨髓移植实验、免疫荧光染色和细胞共培养实验,以验证胞葬作用在肝转移中的作用机制。
研究者对未接受过治疗的转移性PDAC患者的新鲜肝活检样本进行了bulk RNA-seq。结果显示,转移性病变处于免疫沉默状态,富含巨噬细胞和中性粒细胞,而T细胞、B细胞和自然杀伤细胞的特征评分较低。对晚期转移性PDAC病变进行的免疫荧光组织染色显示,病变边缘富含巨噬细胞(CD68),且大多数CD8+T细胞为GZMB阴性。结果提示,PDAC的转移性肿瘤微环境呈现免疫抑制特征,伴随大量转移相关巨噬细胞(MAMs)和较少的CD8+T细胞浸润。
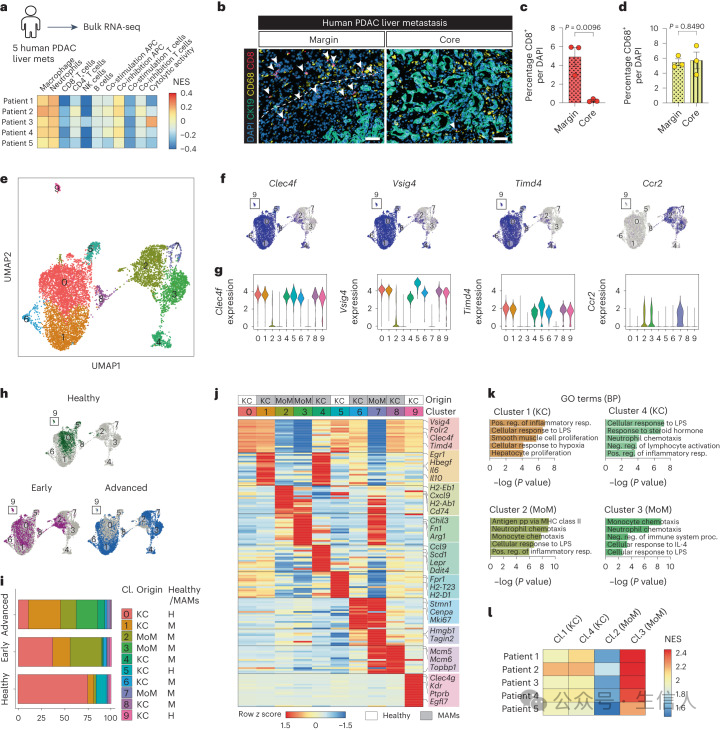
研究者通过对转移性巨噬细胞(MAM)簇的空间分布分析发现,转移性浸润的pMAM来源于单核细胞,而dMAM主要由组织驻留的库普弗细胞(KCs)组成(见图2b)。对来自PDAC患者的晚期转移性病变以及小鼠模型的组织切片分析均确认转移性肿瘤中巨噬细胞高度浸润。其中,边缘巨噬细胞对KC标记物VSIG4呈阳性,而核心区域的巨噬细胞则为VSIG4阴性。这些数据表明,招募的单核细胞(MoMs)浸润转移性病变,而远离转移性病变的MAM来源于组织驻留的KCs。
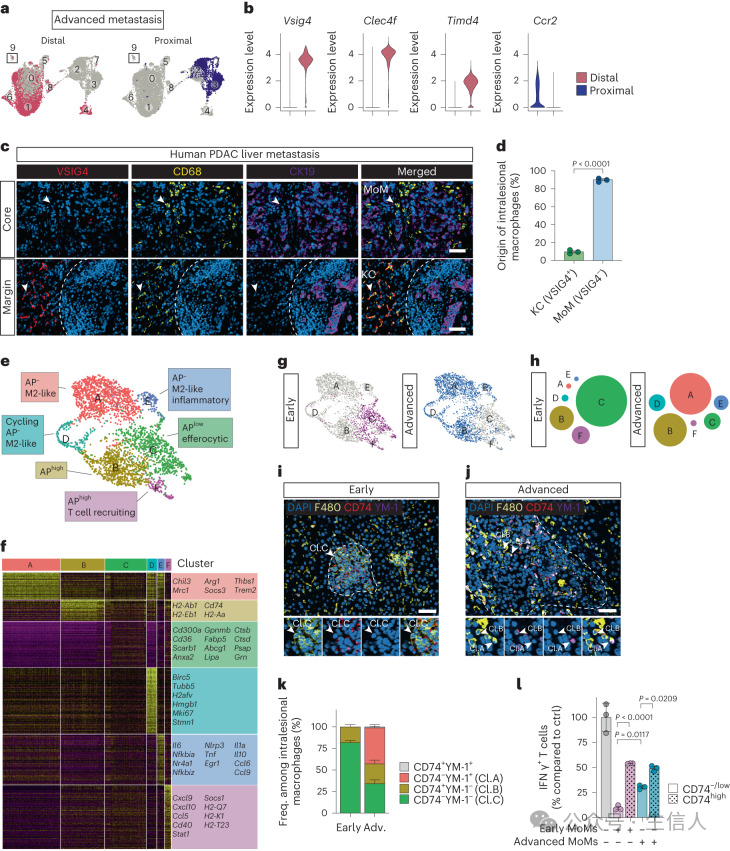
研究者通过3种不同的小鼠模型证实,PDAC肝转移过程中,凋亡细胞吞噬的MoMs亚群早期出现,参与修复因转移相关肝损伤而导致的组织损伤。
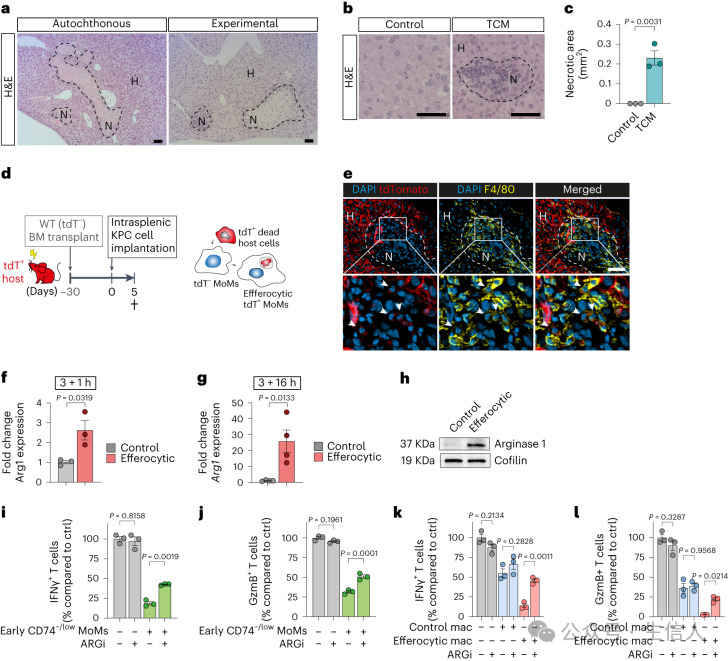
研究者使用酪氨酸蛋白激酶抑制剂UNC2250在体外阻断胞葬过程发现,抑制吞噬凋亡细胞的过程可以有效阻止巨噬细胞的转化及其在PDAC肝转移中的作用,降低了其对T细胞的免疫抑制活性。
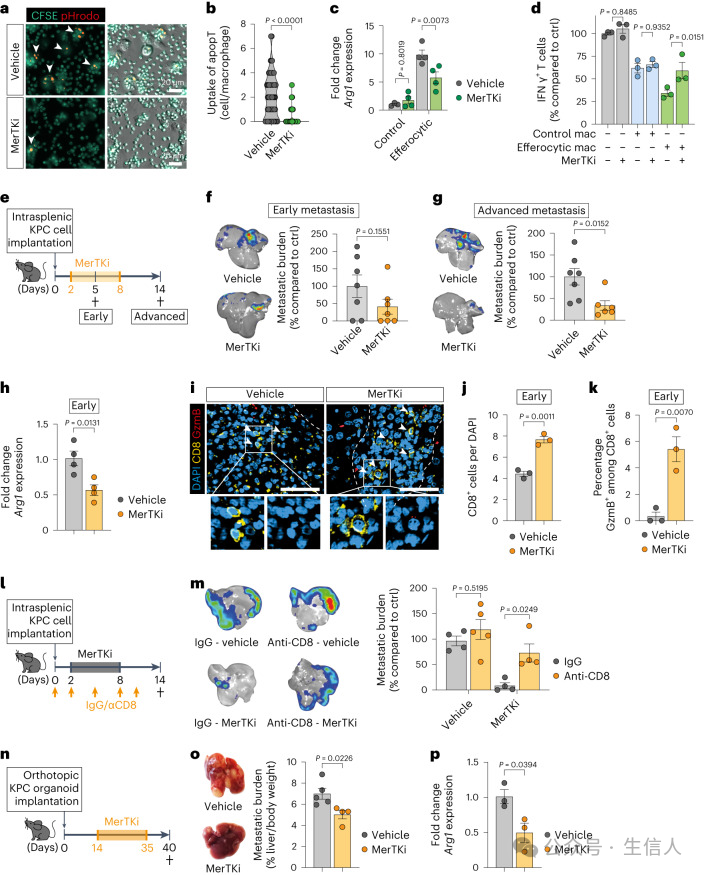
研究者分析了在scRNA-seq中早期Cluster 2 MoM中上调的溶酶体基因。其中,上调的基因之一是颗粒蛋白前体(progranulin, Grn)。研究已证实,巨噬细胞是PDAC肝转移中颗粒蛋白前体的主要来源,并且颗粒蛋白前体的缺乏与对细菌感染的吞噬活性缺陷相关。通过基因敲除技术发现,前颗粒蛋白前体的缺失会导致巨噬细胞吞噬活性下降和抑制CD8+T细胞的功能减弱,从而降低了肝转移的发生。
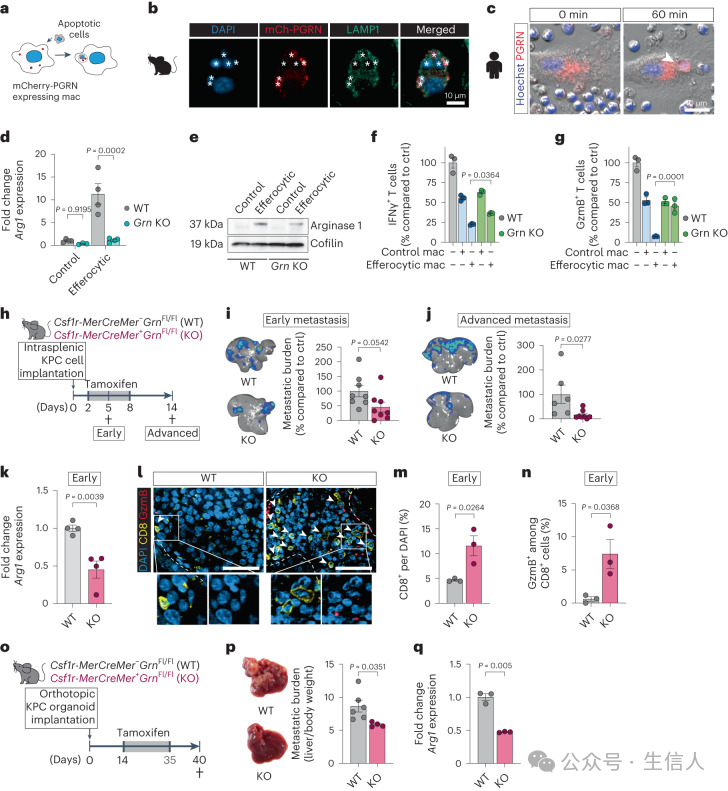
研究者又通过后续实验进一步证明颗粒蛋白前体通过与CFTR相互作用来调节巨噬细胞的溶酶体酸化。颗粒蛋白前体缺乏会降低CFTR水平,从而影响溶酶体酸化和相关的免疫抑制活性。这一机制为理解颗粒蛋白前体在巨噬细胞功能中的作用提供了新的视角。
该研究揭示了胞葬作用通过重新编程巨噬细胞的功能,促进PDAC肝转移的机制。特别是颗粒蛋白前体在巨噬细胞中的表达是这一过程的关键调节因子。通过靶向阻断胞葬作用或干预颗粒蛋白前体表达,有可能抑制肿瘤相关巨噬细胞的免疫抑制作用,提供PDAC肝转移的潜在治疗策略。
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/08/30/%E5%B7%A7%E7%94%A8%E5%9B%BD%E8%87%AA%E7%84%B6%E7%83%AD%E7%82%B9%EF%BC%8C%E8%A7%A3%E9%94%81%E8%82%BF%E7%98%A4%E8%BD%AC%E7%A7%BB%E6%96%B0%E8%A7%86%E8%A7%92/
THE END












赶快来坐沙发