【CACA周刊】73期 表观遗传改变可直接驱动肿瘤发生
本期看点
序言
通常,肿瘤的发生与体细胞突变相关。目前很多肿瘤如肺癌、乳腺癌、胃癌、结直肠癌等都有特定的驱动基因突变,基因检测对于指导靶向用药和评估遗传风险都有着非常重要的意义。
但是,仍然有相当一部分肿瘤患者在不携带驱动基因突变或肿瘤易感基因的情况下罹患肿瘤,这是经典体细胞突变理论所不能解释的,似乎后天的经历和环境对肿瘤的发生起到了更重要的作用。同时,越来越多的研究表明,肿瘤的发生和肿瘤易感性可能与后天的表观基因组的改变密切相关。
表观遗传是指在基因的DNA序列没有发生变化的情况下,基因功能发生了可遗传的变化,并最终导致了表型的变化。例如一对同卵双胞胎有着几乎完全相同的基因,但是即使在同一个环境中长大,他们也会在性格、健康等方面存在较大的差异。这就是表观遗传起作用的直接表现。
从2000年 Robert Weinberg和 Douglas Hanahan教授在 Cell 杂志首次提出“ Hallmarks of Cancer”至2022年 Cancer Discovery 刊登第三版“ Hallmarks of Cancer: New Dimentions”,22年的时间内三版肿瘤特征的更新镌刻了人类对肿瘤认知不断前进的缩影。
在第一版中,肿瘤细胞的六个获得性特征为持续的增殖信号、逃避生长抑制、抵抗细胞死亡、无限复制、血管新生和侵袭转移。
在第二版中,新增了四个观点,分别为基因突变、促瘤炎症、能量异常和免疫逃逸。其中的基因突变观点指,在正常情况下细胞的自然突变率保持较低的水平,但在大部分的肿瘤细胞中基因组存在不稳定的情况,导致基因突变率增加,可使肿瘤细胞继发多种关键的驱动基因突变。这里面,P53的突变和端粒DNA的缺失是基因组不稳定的重要原因。
到了第三版,四个新特征的添加使得该Hallmarks几乎完全涵盖了当下我们对肿瘤细胞特征的全部理解,它们分别为:解锁表观遗传可塑性、非突变表观遗传重编程、多态微生物组和衰老细胞。两大表观遗传特征的添加为肿瘤的发生和发展提供了新的视角,人们开始意识到,表观遗传的改变或许可以扭转细胞命运,最终导致肿瘤发生。这也可以解释不良环境因素、不良生活习惯和不良情绪相关的肿瘤发病风险。
2024年5月,Martinez和Cavalli在 Nature 共同通讯指出,在果蝇中,多梳家族(PcG)蛋白功能的干扰可以直接导致细胞不可逆地转变为癌细胞,该过程无需驱动基因突变。
尽管肿瘤的发生和发展通常与体细胞突变的积累有关,但是许多表观遗传改变也是肿瘤发生和肿瘤易感性的基础,因此遗传学改变可能并非恶性转变的唯一驱动力。
遗传、表观遗传和环境的影响是紧密交织在一起的,因此很难将它们各自对细胞命运决定的贡献分开。该研究的主要目的,就是探究单纯表观遗传机制是否足以启动肿瘤发生。
近年来,人类对癌症相关表观遗传变化的认识越来越深入,表观遗传因子诸如染色质修饰蛋白和染色质重塑蛋白共同调控着组蛋白标记、DNA甲基化、micro-RNA和3D基因组折叠,这些都被认为在肿瘤发生、发展、转移、耐药中起着重要的作用。已经有研究发现表观遗传改变在血癌和实体瘤中的作用,其中部分表观修饰蛋白如HDAC已成为肿瘤治疗中表观遗传修饰药物的靶点。
PcG是表观遗传领域的重要蛋白家族,形成两类高度保守的复合物(PRC1和PRC2),在整个发育过程中起着至关重要的作用。PRC1在果蝇中与H2AK118UB标记相关,而PRC2与H3K27me3标记相关,这两种标记都是抑制基因表达的。
研究者发现,尽管瞬时KD后可逆或不可逆基因的染色质修饰(H3K27me3、H2AK118UB)的恢复是相似的,但部分基因的表达出现不可逆变化。这些不可逆上调的基因有部分表现出H3K27Ac这一活化修饰的轻微上调,但也有相当的部分不含H3K27Ac峰。
研究者对这些基因进行了分析,发现不可逆的转录变化正是驱动肿瘤发生的罪魁祸首。奇怪的是,这些不可逆的基因在瞬时KD后基本重建了正常的染色质Landmark和PcG结合频率,但依然获得了更活跃的表达能力。为何这些区域的抑制性状态恢复了,但区域内的基因表达仍然上调?
为进一步探究其中的原因,研究者进行了ATAC-seq研究染色质开放程度,找到了1220个可逆峰和446个不可逆峰。结合RNA-seq,研究者发现这些不可逆峰和不可逆基因具有显著重叠。
进一步分析发现,可及性的显著差异来源于基因的转录因子结合基序的显著差异。
举例来说,在果蝇模型中,PcG介导的沉默的瞬时中断不可逆地激活了JAK-STAT途径,从而诱导了细胞增殖和相关基因的表达,最终引发了肿瘤的发生。
这不禁让我们又想起2018年饶毅和朱冰的经典辩论,相比于经典的转录因子调控,表观遗传调节在细胞命运决定中起了多大的作用?
本文的结果又为这场永不停息的辩论增添了新的论点:表观遗传的瞬时改变会影响转录因子调控,而本案例中的这些不可逆基因一旦激活了转录因子调控,表观遗传的重建将无法逆转基因表达的上调,这最终导致肿瘤的发生。
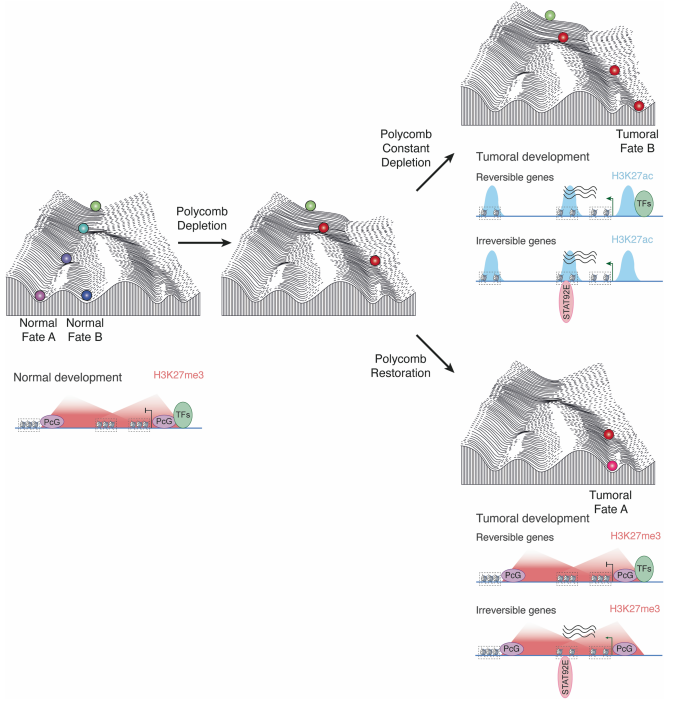
这张经典的细胞命运决定图提醒着我们,细胞命运如同下山,走错了路进错了山谷想要回头真的很难。每一口酒、每一根烟都致命,每一次熬的夜、生的气都在将细胞推向深渊。所以,请保持健康的生活习惯,共勉!
药事纵横
……
1-
6月1日, Journal of Clinical Oncology :同济大学附属东方医院周彩存教授报告泰莱替尼治疗ROS1 + NSCLC的Ⅱ期TRUST-Ⅰ研究结果,颅内活性优秀 [1] 。
泰莱替尼是一种具有中枢神经系统活性的ROS1 + TKI,具有良好的颅内ORR和优秀的抗G2032R活性。该研究是在中国治疗ROS1 + NSCLC的关键性Ⅱ期TRUST-Ⅰ研究,主要评估未接受TKI或事先接受克唑替尼治疗的患者,主要终点为独立审查委员会确认的ORR,次要终点包括DOR、PFS和安全性。
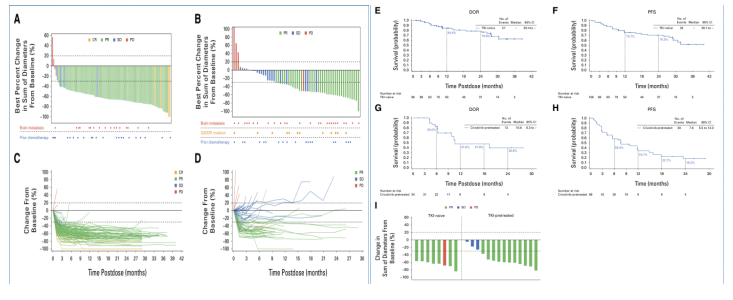
截至2023年11月,研究共入组173例患者(中位年龄55岁;58%为女性;73%从不吸烟;未接受TKI治疗:n=106;克唑替尼预处理:n=67)。在未接受过TKI的患者中,cORR和颅内cORR分别为91%和88%,在克唑替尼预治疗的患者中分别为52%和73%。在未接受过TKI的患者中,中位DOR和中位PFS均为NR,随访时间分别为22个月和23.5个月。在克唑替尼预处理的患者中,中位DOR为10.6个月(95% CI:6.3~NR;8.4个月随访),中位PFS为7.6个月(95% CI:5.5~12.0个月;随访9.7个月)。12例G2032R突变患者中有8例(67%)有反应。
最常见的TEAE是AST升高(76%)、腹泻(70%)和ALT升高(68%),大多数为1~2级。神经系统TEAE的发生率较低(头晕:23%;味觉障碍:10%),大多为1级。由于TEAE导致停药(5%)和剂量减少(19%)的患者比例较少。
2-
6月2日, The New England Journal of Medicine :上海交通大学医学院附属胸科医院陆舜教授报告奥希替尼在不可切除Ⅲ期EGFR突变NSCLC患者中的疗效和安全性 [2] 。
奥希替尼是EGFR突变晚期NSCLC的推荐治疗方案,也是可切除EGFR突变NSCLC的推荐辅助治疗方案。该Ⅲ期、双盲、安慰剂对照试验纳入放化疗期间或放化疗后无进展的不可切除EGFR突变Ⅲ期NSCLC患者。主要终点是BICR评估的PFS。
共有216例接受放化疗的患者被随机分配接受奥希替尼(143名患者)或安慰剂(73名患者)。与安慰剂相比,奥希替尼显著获益:奥希替尼组的PFS为39.1个月,安慰剂组为5.6个月,疾病进展或死亡的风险比为0.16(95% CI:0.10~0.24; P <0.001)。奥希替尼组在12个月时存活且无进展的患者百分比为74%(95% CI:65~80),安慰剂组为22%(95% CI:13~32)。中期OS数据(成熟度20%)显示,84%的奥希替尼组(95% CI:75~89)和74%的安慰剂组(95% CI:57~85)组患者的总生存期为36个月,死亡风险比为0.81(95% CI:0.42~1.56; P =0.53)。
奥希替尼组3级或以上不良事件的发生率为35%,安慰剂组为12%;放射性肺炎(分级1、2)分别为48%和38%。没有出现新的安全问题。
3-
6月3日, Journal of Clinical Oncology :同济大学附属东方医院周彩存教授报告塞普替尼在 RET融合阳性NSCLC患者中的CNS活性 [3]。
尽管塞普替尼在RET融合阳性NSCLC患者中的CNS活性已经被观察到,但是其抑制CNS转移能力缺乏随机临床研究数据。Ⅲ期LIBRETTO-431研究比较了塞普替尼和铂类/培美曲塞±帕博利珠单抗治疗这些患者的疗效,通过神经放射学BICR评估颅内结局。
在192例帕博利珠单抗意向治疗且接受基线中枢神经系统扫描的患者中,150例没有基线中枢神经系统转移。与化疗+帕博利珠单抗相比,塞普替尼降低了这些患者CNS进展的累计发生率(HR:0.17;95% CI:0.28~1.97),颅内PFS的HR为0.46(95% CI:0.18~1.18)。在42例基线CNS转移患者中,CNS进展的累积发生率(HR:0.61;95% CI:0.19~1.92)和颅内PFS的累积发生率(HR:0.74;95% CI:0.28~1.97)趋势相似。
这些数据表明,塞普替尼可有效治疗RET融合阳性NSCLC患者现有的中枢神经系统疾病,并预防或延缓新中枢神经系统转移的形成。
4-
6月6日, Journal of Clinical Oncology :上海交通大学医学院附属胸科医院陆舜教授报告Telisotuzumab-Vedotin单药治疗既往接受过治疗的c-Met过表达的晚期非鳞状EGFR野生型NSCLC患者的疗效和安全性 [4] 。
该Ⅱ期LUMINOSITY研究在第一阶段旨在确定Teliso-V治疗的最佳c-Met蛋白过表达NSCLC人群,并在第2阶段扩大选定的疗效评估组。第二阶段招募非鳞状EGFR野生型NSCLC患者。入组患者患有局晚期/转移性c-Met过表达(≥25%的肿瘤细胞具有3+染色)NSCLC,接受≤2线治疗(包括≤1线全身化疗)。c-Met高为≥50% 3+,中为≥25%但<50%。主要终点为BICR评估的ORR。
总共有172名非鳞状EGFR野生型NSCLC患者在一期和二期接受了每周1.9 mg/kg Teliso-V。ORR为28.6%(95% CI:21.7~36.2;c-Met高:34.6%[24.2~46.2];c-Met中:22.9%[14.4~33.4])。中位缓解持续时间为8.3个月(95% CI:5.6~11.3;c-Met高:9.0[4.2~13.0];c-Met中:7.2[5.3~11.5])。中位OS为14.5个月(95% CI:9.9~16.6;c-Met高:14.6[9.2~25.6]:c-Met中:14.2[9.6~16.6])。中位PFS为5.7个月(95% CI:4.6~6.9;c-Met高:5.5[4.1~8.3];c-Met中:6.0[4.5~8.1])。
最常见的任何级别TRAE是周围感觉神经病变(30%)、外周水肿(16%)和疲劳(14%);最常见的≥3级是周围感觉神经病变(7%)。
5-
6月10日, The Lancet Respiratory :上海交通大学医学院附属胸科医院陆舜教授报告格舒瑞昔在局部晚期或转移性KRAS G12C NSCLC患者中的疗效和安全性 [5] 。
格舒瑞昔在KRAS G12C NSCLC Ⅰ期研究中已经展现出良好的抗肿瘤活性。该开放标签、多中心、单臂、Ⅱ期试验招募了KRAS G12C NSCLC的成年患者,这些患者之前曾接受过铂类化疗和免疫检查点抑制剂治疗。参与者每天两次口服600 mg格舒瑞昔。在基线、前八个周期中每两个周期(21天)结束时以及八周期后每三个周期结束时进行肿瘤评估。主要终点是ORR,由IRC根据RECIST v1.1评估。
在接受资格筛查的225名患者中,有123名患者入组并接受格舒瑞昔治疗。在这123名参与者中,中位年龄为64岁(IQR:59~68),108名(88%)为男性,15名(12%)为女性。截至数据截止日(2023年11月17日),中位随访时间为7·9个月(IQR:6.3~10.4),123例患者中有82例(67%)已停止治疗。IRC确认的ORR为50%(123例患者中有61例;95% CI:41~59)。
123例患者中有117例(95%)报告了TRAE,其中61例(50%)经历了3级或更高级别的事件。与格舒瑞昔相关的3级或更高级别的最常见的AE类型是肝脏和胃肠道事件,包括肝酶升高如天冬氨酸氨基转移酶(123名受试者中的21名[17%])、丙氨酸氨基转移酶(123名受试者中的19名[15%])和γ-谷氨酰转移酶(123名受试者中的28名[23%]);恶心(123名受试者中有2名[2%]);呕吐(123名受试者中有2名[2%])。没有发现新的安全信号,大多数不良事件都得到了很好的管理。
6-
6月, Nature Medicine :纳武利尤单抗联合或不联合瑞拉利单抗治疗可切除的NSCLC的随机Ⅱ期NEOpredict-Lung试验结果公布 [6]。
免疫检查点抑制剂单药或联合化疗是大多数转移性NSCLC患者的标准治疗,尽管免疫检查点抑制剂和化疗在疗效方面存在明显的相互作用,但并非所有NSCLC患者都需要化疗的额外毒性来发挥免疫治疗的全部治愈潜力。LAG-3抗体的加入可能带来更优的肿瘤反应和无事件生存期。
该研究是一项正在进行的开放标签的Ⅱ期研究,纳入60名未选择生物标志物的、未接受过治疗的NSCLC患者,随机分配接受两种术前剂量的纳武利尤单抗联合或不联合瑞拉利单抗。

主要研究终点是43天内手术的可行性,所有患者均达到。95%的患者实现了根治性切除。次要终点包括病理和影像学反应率、病理完全切除率、无病生存率和总生存率以及安全性。本研究分别在27%和10%(纳武利尤单抗)和30%和27%(纳武利尤单抗和瑞拉利单抗)的患者中实现了主要病理学(≤10%活肿瘤细胞)和客观影像学反应。在100%(纳武利尤单抗)和90%(纳武利尤单抗和瑞拉利单抗)的患者中,肿瘤和淋巴结在病理学上完全切除。中位随访时间为12个月,12个月时的无病生存率和总生存率分别为89%和93%(纳武利尤单抗)、93%和100%(纳武利尤单抗和瑞拉利单抗)。
两种治疗都是安全的,每个研究组分别有10%和13%的患者报告了≥3级治疗中出现的AE。
本研究确定了纳武利尤单抗和瑞拉利单抗术前治疗可切除NSCLC ⅠB、Ⅱ和ⅢA期患者的可行性和安全性。
7-
6月14日, Signal Transduction and Targeted Therapy :同济大学附属上海市肺科医院的姜格宁、张鹏教授报告新辅助卡瑞利珠单抗联合化疗或阿帕替尼在最初不可切除的Ⅱ~Ⅲ期NSCLC患者中的疗效和安全性结果 [7]。
无论PD-L1表达如何,入组患者每3周接受一次新辅助卡瑞利珠单抗200 mg和铂类双药化疗(A组)或新辅助卡瑞利珠单抗和阿帕替尼250 mg每日一次(PD-L1阳性,B组),持续2~4个周期,然后进行手术。主要终点是MPR率。
A组30例患者和B组21例患者入组。A组手术率为50.0%(15/30),B组手术率为42.9%(9/21),所有患者均达到R0切除。在这些患者中,A组的MPR和pCR均为20.0%(95% CI:4.3~48.1),B组分别为55.6%(95% CI:21.2~86.3)和11.1%(95% CI:0.3~48.2)。相应的ORR分别为33.3%(95% CI:11.8~61.6)和55.6%(95% CI:21.2~86.3)。中位随访时间为22.4个月(95% CI:19.0~26.0),A组未达到中位EFS(NR;95% CI:13.6~NR),B组为16.8个月(95% CI:8.6-NR)。
A组8例(26.7%)患者和B组3例(14.3%)患者发生3级或以上治疗相关不良事件。
生物标志物分析显示基线TYROBP表达可预测B组的治疗反应。新辅助卡瑞利珠单抗联合化疗或阿帕替尼在最初不可切除的Ⅱ~Ⅲ期NSCLC患者中表现出初步疗效和可控的毒性。
医谷回声
……
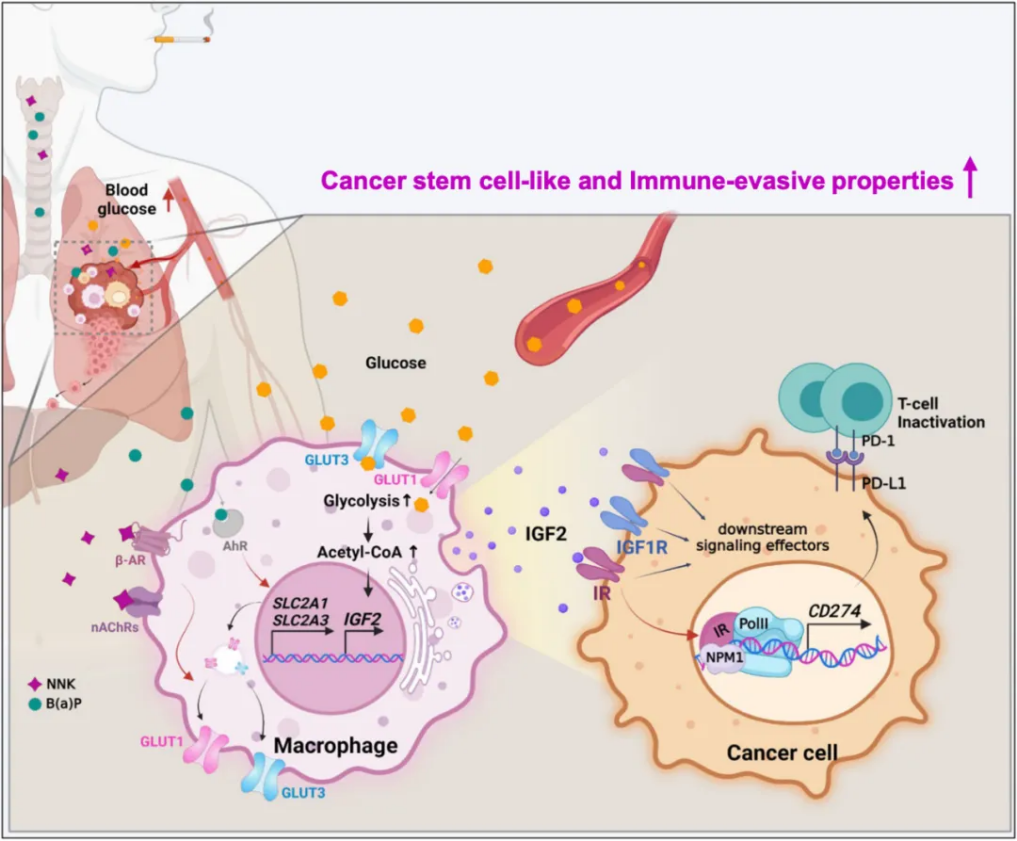
6月8日, Nature Communications :揭示吸烟促进肺癌进展新机制 [8]。
既往研究显示,吸烟(TS)可通过代谢综合征的发展促进肺癌(LC)进展,但目前尚无直接证据可将代谢综合征与TS介导的LC进展联系起来。因此,研究人员试图探究烟草烟雾中的关键致癌成分4-(甲基亚硝胺基)-1-(3-吡啶基)-1-丁酮(NNK)和苯并[a]芘(BaP)(简称NB)与代谢综合征的关系。
从机制上来说,NB通过增加葡萄糖转运蛋白GLUT1和GLUT3的表达和表面定位,增强了肿瘤相关巨噬细胞(TAM)对葡萄糖的摄取。这一过程导致胰岛素样生长因子2(IGF2)的转录上调,进而以旁分泌方式激活肺癌细胞中的胰岛素受体,进入细胞核与核仁蛋白(NPM1)结合,导致CD274启动子激活和PD-L1表达。因此通过限制糖酵解、消耗TAM或阻断PD-L1,都可以抑制NB介导的LC进展。
此外,通过对患者组织和公共数据库的分析,研究人员发现TAM中IGF2和GLUT1水平会升高,肿瘤中PD-L1和磷酸化胰岛素样生长因子1受体/胰岛素受体(pIGF-1R/IR)的表达也会增加,这些都可能是潜在的LC不良预后生物标志物,值得进一步探究。
高峰科讯
……
1-
6月11日, Nature Communications :南方医科大学周军教授、郑浩轩副教授共同通讯报告MYG1通过核-线粒体协作驱动糖酵解和结直肠癌发展 [9] 。
代谢重塑作为肿瘤在压力下的一种生存策略,让CRC细胞能够在复杂的应激条件下存活,了解代谢重塑的机制将为预防CRC和改善患者预后提供新的方法。黑素细胞增殖基因1(MYG1)是一种3'-5' RNA外切酶,在线粒体功能中起到关键性作用,既往研究证实其可激活AMPK/mTOR复合体1信号通路并抑制肺腺癌细胞的自噬,但目前尚不清楚MYG1在肿瘤,尤其是CRC中有何特异性功能。
本研究发现MYG1可在CRC进展过程中表达上调,促进糖酵解和CRC进展,且这种促进作用与其外切酶活性无关。从机制上来说,细胞核内MYG1招募HSP90/GSK3β复合物促进PKM2磷酸化,增加其稳定性,PKM2进而转录激活MYC,并促进MYC介导的糖酵解。与此同时,c-MYC也会转录上调MYG1,推动CRC的进展。线粒体内的MYG1一方面抑制氧化磷酸化,另一方面阻止细胞色素c从线粒体释放,抑制细胞凋亡。
2-
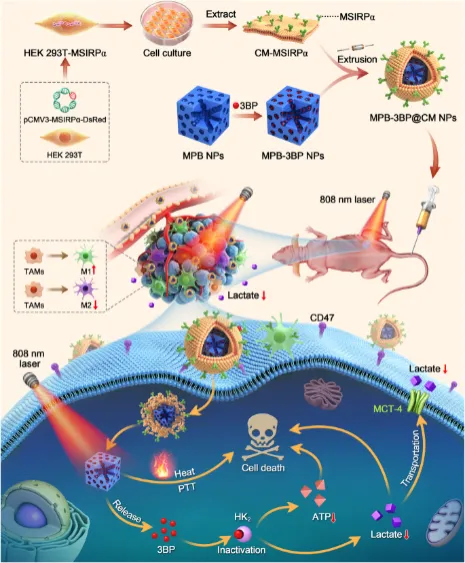
6月12日, Signal Transduction and Targeted Therapy :四川大学钱志勇教授团队开发新型基因可编程细胞膜伪装纳米粒子 [10] 。
细胞膜伪装的纳米颗粒具有细胞膜结构和表面抗原带来的固有优势(包括延长在血液中的循环时间、特定的细胞识别、靶向能力以及免疫治疗潜力等)。
基于此,研究人员开发了一种细胞膜仿生纳米药物平台(MPB-3BP@CM NPs)。该平台由微孔普鲁士蓝纳米颗粒(MPB NPs)组成,这些纳米颗粒既可作为光热增敏剂介导光热疗法进一步提高对肿瘤的疗效;又可作为3-溴丙酮酸(3BP)的载体,搭载己糖激酶Ⅱ(HK2)抑制剂3BP抑制糖酵解,减少ATP水平和乳酸生成。
此外,MPB-3BP@CM NPs外包含有信号调节蛋白α(SIRPα)变体的基因可编程细胞膜,可在血液中循环更长时间,有效靶向结直肠癌(CRC)细胞膜上的CD47,增强巨噬细胞对CRC细胞的吞噬作用。MPB-3BP@CM NPs有望为肿瘤治疗定制疾病专属细胞膜,成为开发新一代CRC治疗方法的创新平台。
3-
6月12日, Nature :肥胖诱导巨噬细胞表达PD-1以抑制机体抗肿瘤免疫反应,但同时可提高肥胖患者对PD-1免疫疗法的反应 [11] 。
肥胖是许多癌症进展和转移的主要风险因素之一,但有时肥胖也可以增强患者对免疫检查点抑制疗法的反应,延长生存期。既往研究表明肥胖可引起慢性炎症,但其具体的作用机制尚不清晰。
本研究发现肥胖选择性地诱导了肿瘤相关巨噬细胞(TAMs)上PD-1的表达。从机制上来说,Ⅰ型炎症细胞因子和肥胖相关分子(干扰素-γ、肿瘤坏死因子、瘦素、胰岛素和棕榈酸)通过mTORC1和糖酵解途径诱导了巨噬细胞PD-1表达。PD-1会对TAMs提供负反馈,抑制其糖酵解、吞噬作用和T细胞刺激潜力。因此阻断PD-1可增强TAMs表达CD86、MHC-Ⅰ和MHC-Ⅱ分子,减缓肿瘤生长速度,并导致CD8+ T细胞活性增加。这些发现表明,肥胖相关的代谢信号和炎症提示可让TAMs诱导PD-1表达,进而驱动一种TAM特异性反馈机制,虽然该机制会导致癌症风险增加,但同时也可提高肥胖患者对PD-1免疫疗法的反应。
4-
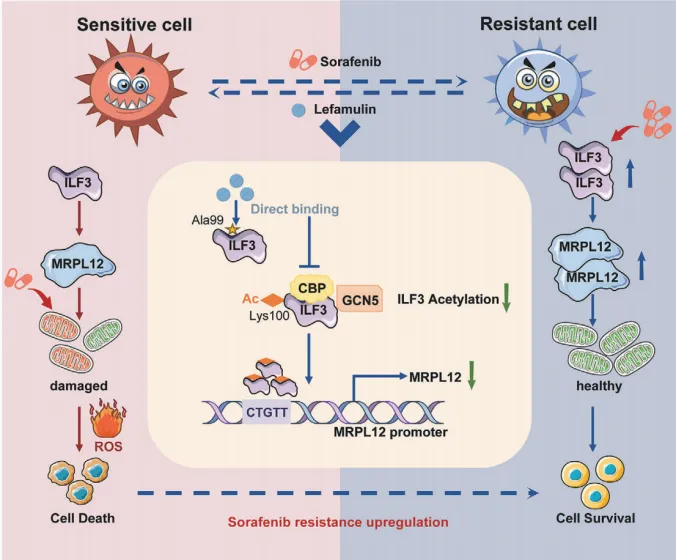
6月14日, Advanced Science :中国药科大学孔令义教授、张浩教授报告靶向肝细胞癌ILF3克服获得性耐药新机制 [12] 。
获得性耐药是分子靶向治疗HCC的关键临床挑战之一,亟须探索能够克服或延缓获得性耐药的新机制和治疗方法。
来法莫林是一种用于治疗社区获得性细菌性肺炎的新型纤维菌素类抗生素,该研究发现来法莫林可通过损害线粒体功能并靶向ILF3来增加HCC对索拉非尼的敏感性。
在机制上来说,来法莫林可直接结合ILF3蛋白的Alanine-99位点,干扰GCN5和CBP介导的赖氨酸-100位点乙酰化,从而破坏线粒体核糖体蛋白L12(MRPL12)的转录及随后的线粒体生成。动物试验证实,来法莫林在小鼠体内耐受性良好,不仅能直接抑制肿瘤进展,而且在细胞系来源的异种移植和流体动力注射小鼠模型中克服了索拉非尼的耐药性,增强其抗肿瘤作用。
高ILF3或MRPL12表达与较差的生存率和靶向治疗效果相关,ILF3有望成为克服TKIs耐药的潜在治疗新靶点。
刊后语
大风泱泱,大潮滂滂;大道如砥,医者无疆。
积跬步以至千里,每一期周刊都是恶性肿瘤学科发展的剪影;积小流以成江海,一年周刊浓缩肿瘤领域各科前沿进展的精华!关注CACA周刊,带你领略恶性肿瘤学科发展的四季花开。
CACA周刊,我们下周不见不散!
编辑 | 李瑞源 YANG
排版 | 晓晓
审核 | 李瑞源
链接:http://www.lewenyixue.com/2024/08/27/%E3%80%90CACA%E5%91%A8%E5%88%8A%E3%80%9173%E6%9C%9F%20%E8%A1%A8%E8%A7%82%E9%81%97%E4%BC%A0%E6%94%B9%E5%8F%98%E5%8F%AF%E7%9B%B4/







赶快来坐沙发