运动与抗肿瘤免疫的关系
癌症是全球主要死亡原因, 2020年约有1000万人死亡,占所有死亡人数的六分之一,全球负担日益加重。然而,大约一半的癌症死亡可以通过改变生活方式和环境相关风险因素来预防。事实上,全球近三分之一的成年人未能达到世界卫生组织关于有氧体育活动的最低建议,即每周适度活动( 如散步 )≥150分钟或每周剧烈活动( 如快走或跑步 )≥75分钟。研究发现,有规律的体育活动与较低的癌症发病率、较低的癌症复发和较低的死亡率相关。
一个多世纪以来,免疫系统对运动诱导的刺激具有高度反应性这一事实已经广为人知。一轮动态的、中等强度的运动( 通常跑步或骑自行车约1 小时 )会诱导所有主要白细胞亚型深入动员进入外周循环。研究发现,具有较高细胞毒性、抗原诱导和迁移潜力的免疫细胞亚型,如自然杀伤( NK )细胞、γδT细胞、CD8+T细胞、CD14+CD16+单核细胞以及CD16-中性粒细胞优先动员。此外,有证据表明,运动对抗肿瘤的免疫效应物( 特别是NK细胞和CD8+T细胞 )有刺激作用,这对于免疫治疗的持久临床反应以及延长癌症患者的一般生存期至关重要。
骨骼肌是一种内分泌器官,它向血液中释放大量信号分子。这些主要包括蛋白质或小肽,例如细胞因子( IL-6、IL-7和IL-15 ),也包括核酸、脂质和代谢产物( 如乳酸盐 )。这些可以自由循环或包装在外泌体中,统称为“肌细胞因子”。
除了代谢和多系统水平的多效性作用外,肌细胞因子还介导免疫特异性作用。例如,收缩肌释放IL-6,IL-6随着运动强度和持续时间呈指数级上升,可能比基线循环水平增加约100倍。尽管IL-6主要具有促炎作用,但当在运动环境中释放时,它会引发整体抗炎作用,尤其是通过诱导其他具有抗炎特性的循环细胞因子的释放,特别是IL-1受体拮抗剂( IL-1RA )和IL-10,同时降低TNF的循环水平。此外,除了非免疫( 主要是代谢 )功能外,运动诱导的IL-6可以与NK细胞结合,并刺激其急性动员到血液中和归巢到肿瘤中去。IL-7和IL-15是常见的γ链受体细胞因子家族成员,也通过收缩肌肉高表达或分泌。IL-7有助于维持胸腺质量并促进幼稚T细胞的输出,这两种细胞因子在αβ和γδT细胞存活和CD8+T细胞稳态中起主要作用,以补充幼稚和记忆亚群。
系统性、低度慢性炎症是衰老和包括癌症在内的许多慢性非传染性疾病的标志,衰老相关的慢性炎症不仅通过增加细胞转化率,而且通过促进免疫抑制细胞类型在肿瘤微环境中的积累,有利于肿瘤发生。而通过反复运动诱导肌肉衍生的细胞因子支持维持健康的免疫效应细胞群,并促进整体抗炎环境。
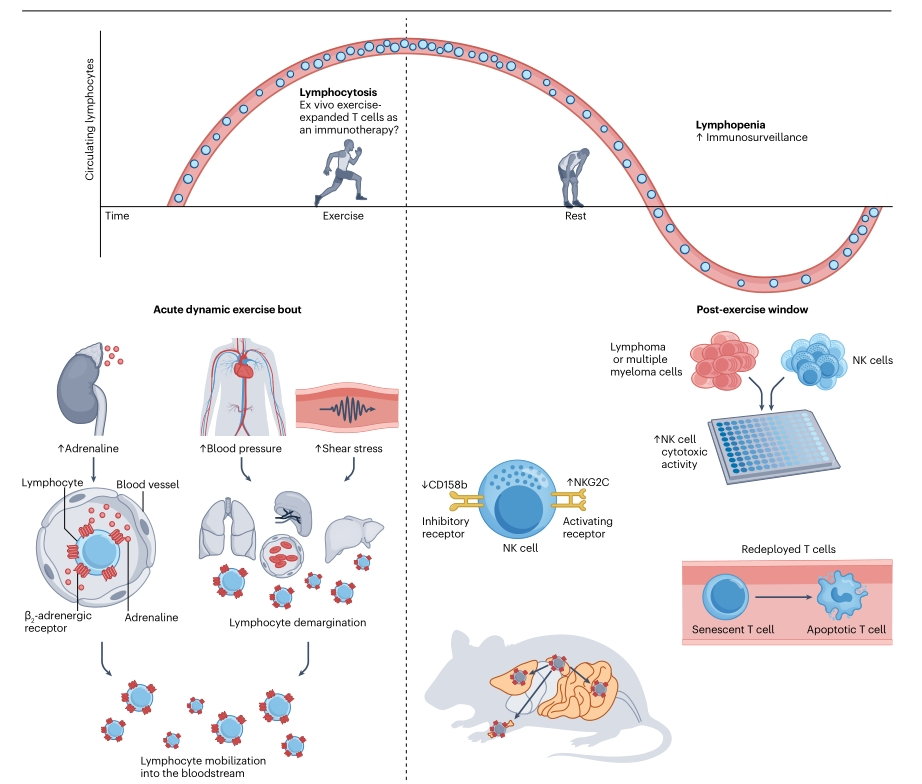
在人类中,急性动态运动持续时间≥ 20–60 分钟在淋巴细胞中诱导双相反应。 初始反应的特征是显著的淋巴细胞增多,主要影响 NK 细胞,其在血液中比基线水平增加数倍。 反应最灵敏的 NK 细胞是成熟的 KIR+ 或 NKG2A − NK 细胞。 CD8+T 细胞和 γδT 细胞分别增加约两倍和三倍。
急性运动优先动员CD8+T细胞和CD3+CD56+NKT样细胞的亚群,这些细胞表现出与分化增加相关的表面表型( KLRG1+、CD57+和CD28- )以及与抗肿瘤活性相关的基因表达;此外,还动员CD14+CD16+单核细胞。
运动过程中的淋巴细胞动员与运动强度成正比,是由血压升高和剪切力驱动的,这些压力和剪切力会导致血管和组织库( 肺、肝和脾 )的缩小,从而增加在外周循环主轴血流中流动的白细胞数量。动员主要通过肾上腺素刺激淋巴细胞表面的β2-肾上腺素能受体来促进,导致内皮分离和淋巴细胞再循环到血液中。运动和儿茶酚胺信号传导影响免疫细胞动员、再分配和功能的分子机制仍有待充分了解。
在运动后的恢复过程中,血淋巴细胞计数开始下降,最低点约为运动后 1-2 小时。 低于运动前水平的短暂性淋巴细胞减少很常见,主要影响 NK 和 CD8+T 细胞,并逐渐恢复到基线水平。 这种急性、短暂性淋巴细胞减少并不反映免疫抑制,而是可能发生在免疫监测改善的情况下。 事实上,在健康个体中, NK 细胞对淋巴瘤和多发性骨髓瘤细胞系的细胞毒性能力在运动 1 小时后增加 60% ,这伴随着表达抑制性受体 CD158b 的 NK 细胞比例降低和表达激活受体 NKG2C 的 NK 细胞的增加。 此外,急性运动优先将高分化的 T 细胞动员到循环中,其中许多 T 细胞表现出与耗竭和终末分化相关的表型,它们会被新的幼稚 T 细胞代替。
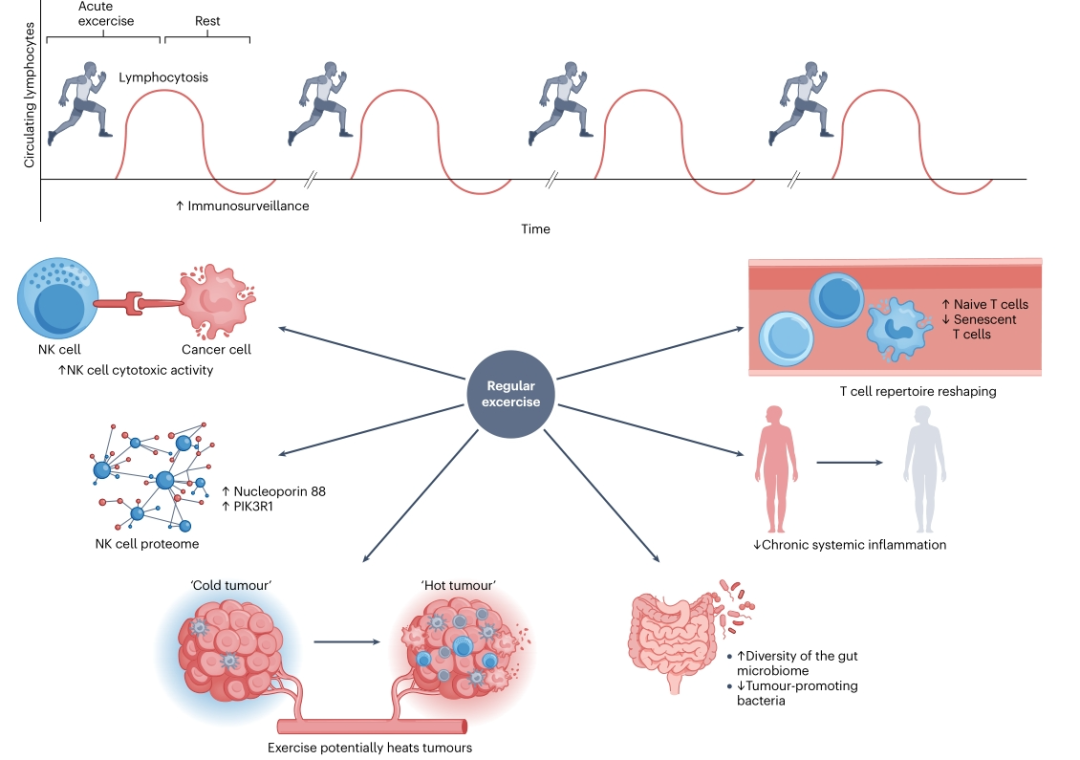
日常规律运动的长期有益效果得益于“反复急性运动”的累积影响。 由于每次运动都会诱导肌细胞因子或运动因子分泌,并诱导大量淋巴细胞的重新分布,因此定期运动对免疫功能的影响,尤其是对抗肿瘤免疫功能的作用,可能至少部分与效应淋巴细胞的频繁急性动员或再分配的逐渐积累有关。 使用 “ 动态 ” 终点,如 NK 细胞或其他免疫细胞群体进入和渗透肿瘤的能力,可以更好地观察对运动训练的免疫适应。
尽管单次运动可以将NK细胞动员到血液中,但这不足以增加肿瘤NK细胞浸润。然而,在8周的时间里,随着训练次数越多,恶性肿瘤患者的肿瘤NK细胞浸润越多。因此,尽管一次运动不会改变癌症患者的血液炎症标志物,但随着IL-1RA的增加,后续运动会产生累积效应。
在患有癌症( 或有患癌症风险 )的人中,运动训练干预措施可能不一定会影响NK细胞活性。然而,有证据表明,在慢性淋巴细胞白血病患者进行12周的HIIT和阻力训练干预后,以及在切除乳腺癌或结肠癌妇女的新辅助化疗后进行9-12周有氧和阻力训练,NK细胞活性显著增强。值得注意的是,训练诱导的NK细胞活性增加与蛋白质组水平的变化相关,包括PIK3R1的上调,这是NK细胞成熟、归巢、启动和功能所必需的,以及核通道蛋白88,一种普遍存在的参与免疫反应的转录因子,它选择性介导NF-κB的核转运。此外,定期运动也可以通过降低介导抗肿瘤反应能力受损的功能失调和衰老T细胞的比例来重塑T细胞库,同时增加能够识别和应答新抗原的初始CD8+T细胞( CD45RA+CD27+CD62L+CR7+ )的比例。
除了运动对免疫细胞的直接影响之外,最近的一项研究得出结论,身体活动的有益效果与肠道微生物群多样性的增强有关。此外,运动似乎还增加了与肿瘤生长迟缓相关的细菌( 如粪杆菌 )的丰度,并减少了与促进肿瘤生长相关的细菌菌株。
生物学证据表明,有规律的体育活动或锻炼具有免疫刺激作用,尤其是在每次急性运动后的几个小时内刺激免疫细胞动员。与免疫治疗方法相比,运动的有益免疫作用不会伴随着有害的副作用,根据每个患者的个体特征仔细调整运动计划可以对健康状况产生积极影响,即使是晚期癌症患者也是如此。因此,生命在于运动,它可以有效地帮助我们增强对癌症的抵抗。
参考文献
1.Theeffect of physical exercise on anticancer immunity. Nat Rev Immunol.2023Oct 4.
链接:http://www.lewenyixue.com/2024/08/22/%E8%BF%90%E5%8A%A8%E4%B8%8E%E6%8A%97%E8%82%BF%E7%98%A4%E5%85%8D%E7%96%AB%E7%9A%84%E5%85%B3%E7%B3%BB/




 知道|国家药品不良反应监测年度报告(2024年)
知道|国家药品不良反应监测年度报告(2024年)
赶快来坐沙发