Nat Commun丨万里玲团队通过单细胞组学揭示肾母细胞瘤的基因突变如何破坏肾脏发育
正常的细胞分化依赖精确的表观遗传和转录调控。破坏这些调控机制的基因突变会导致发育障碍和恶性肿瘤,尤其是儿童肿瘤。然而,在大多数组织类型中,细胞命运的决定过程及其异常如何影响正常发育并导致疾病,仍不清楚。
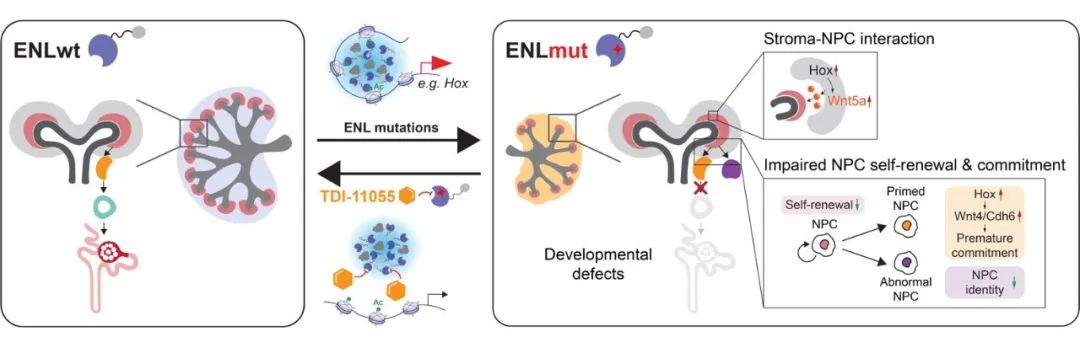
近日, 万里玲团队 在 Nature Communications 发表了题为 Single-Cell multiomics reveals ENL mutation perturbs kidney developmental trajectory by rewiring gene regulatory landscape 的文章。 该研究结合小鼠模型和单细胞组学方法,揭示了ENL突变如何通过重塑基因调控景观,扰乱肾脏发育。研究还发现,小分子抑制剂可以有效阻止ENL突变引起的转录凝聚体形成和靶基因的过度活化,从而缓解肾脏发育缺陷。 这是首次解析表观遗传调控因子突变在肾脏发育中的作用,并提供了潜在的Wilms tumor靶向治疗方法。
为了研究ENL基因突变在体内的功能,研究人员创建了携带该突变的小鼠模型。实验显示,诱导ENL突变的表达阻碍了胚胎肾脏发育,导致小鼠肾脏功能障碍和出生后死亡。组织学分析表明,表达ENL突变的肾脏缺乏成熟结构并形成了癌前病变。通过单细胞转录组测序(scRNA-seq),研究人员发现ENL突变改变了胚胎肾脏的细胞组成和肾单位的分化路径,并在肾单位祖细胞和早期分化细胞中引起了与细胞自我更新和分化密切相关的转录水平变化。进一步的单细胞染色质可及性分析(snATAC-seq)显示,ENL突变显著上调了特定转录因子(如HOX)及其下游基因(如Wnt4, CDH6)的表达,限制了早期分化细胞的成熟。突变还诱发了一种异常细胞类型,这些细胞丢失了肾发育相关的染色质特性。研究还发现,ENL突变改变了Foxd1+基质 (stroma)祖细胞的染色质可及性,异常激活了旁分泌的Wnt信号,影响基质-肾单位相互作用,最终导致肾脏发育缺陷。
该研究结合转基因小鼠建模、组织学分析、单细胞多组学分析和小分子抑制剂干预的方法,首次揭示了突变的表观遗传调控因子在肾脏发育和病理发生中的生物学功能及单细胞水平的分子机制。研究表明,通过靶向表观遗传调控因子可以纠正发育缺陷,为未来在肾母细胞瘤或其他疾病中的类似研究提供了新的范例。
宾夕法尼亚大学医学院的宋乐乐博士和李青蓝博士为论文的共同第一作者。万里玲博士为通讯作者。本研究得到了宾夕法尼亚大学Hao Wu, Katalin Susztak和Kotaro Sasaki团队以及清华大学李海涛团队的支持。
责编

制作
排版 | Sheila 校对 | uu
▼滑动查看更多▼
How disruptions to normal cell differentiation link to tumorigenesis remains incompletely understood. Wilms tumor, an embryonal tumor associated with disrupted organogenesis, often harbors mutations in epigenetic regulators, but their role in kidney development remains unexplored. Here, we show at single-cell resolution that a Wilms tumor-associated mutation in the histone acetylation reader ENL disrupts kidney differentiation in mice by rewiring the gene regulatory landscape. Mutant ENL promotes nephron progenitor commitment while restricting their differentiation by dysregulating transcription factors such as Hox clusters. It also induces abnormal progenitors that lose kidney-associated chromatin identity. Furthermore, mutant ENL alters the transcriptome and chromatin accessibility of stromal progenitors, resulting in hyperactivation of Wnt signaling. The impacts of mutant ENL on both nephron and stroma lineages lead to profound kidney developmental defects and postnatal mortality in mice. Notably, a small molecule inhibiting mutant ENL’s histone acetylation binding activity largely reverses these defects. This study provides insights into how mutations in epigenetic regulators disrupt kidney development and suggests a potential therapeutic approach.
DOI: 10.1101/2024.05.09.591709
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/08/14/Nat%20Commun%E4%B8%A8%E4%B8%87%E9%87%8C%E7%8E%B2%E5%9B%A2%E9%98%9F%E9%80%9A%E8%BF%87%E5%8D%95%E7%BB%86/
THE END







赶快来坐沙发