Nature | 免疫逃逸竟与脂质有关!美国科学家揭示鞘糖脂合成介导KRAS驱动的癌症的免疫逃逸
撰文:皮代谷
IF : 50.5
推荐度:
亮点:
1、 该文章通过使用功能基因组学和脂质组学方法,确定了从头鞘糖脂合成是介导 KRAS 驱动的癌细胞免疫逃避的重要途径。
2、 实验证明了阻断鞘糖脂的产生可增强自然杀伤细胞和 CD8+T 细胞对肿瘤细胞的抗增殖作用。
3、 证明了使用鞘糖脂合成的抑制剂与检查点阻断疗法,可协同增强抗肿瘤免疫反应。
近日,美国洛克菲勒大学的 Kıvanç Birsoy 教授在国际知名期刊 《 NATURE 》 发表了题为: Glycosphingolipidsynthesis mediates immune evasion in KRAS-driven cancer 的研究文章。
该研究中研究者团队使用功能基因组学和脂质组学方法,揭示了鞘糖脂的合成是 KRAS 驱动的癌细胞免疫逃避的关键内源性限制。从机制上讲,鞘糖脂的消耗可以增加了 IFNγ 受体亚基 1 (IFNGR1) 的表面水平, IFNGR1 介导 IFNγ 诱导的生长停滞和促炎信号传导。最后证明了糖鞘脂合成的药理抑制与检查点阻断疗法协同作用,增强抗肿瘤免疫反应。这些研究结果对后继的肿瘤免疫治疗研究与重要的意义。
1. 前言
脂质是一组复杂多样的生物分子,对膜稳态、信号传导和能量产生至关重要。快速增殖的癌细胞需要持续的脂质供应来支持细胞生长和适应环境。参与脂质合成和摄取的代谢基因是致癌改变的下游效应因子,在肿瘤中通常被上调。
有研究表明,在小鼠模型中,通过高脂肪喂养获得的膳食脂质促进肿瘤起始、转移和免疫逃逸。但确切地说,哪些脂质有助于肿瘤发生和免疫逃避及其机制尚不清楚。
2. 鞘脂合成促进免疫逃避
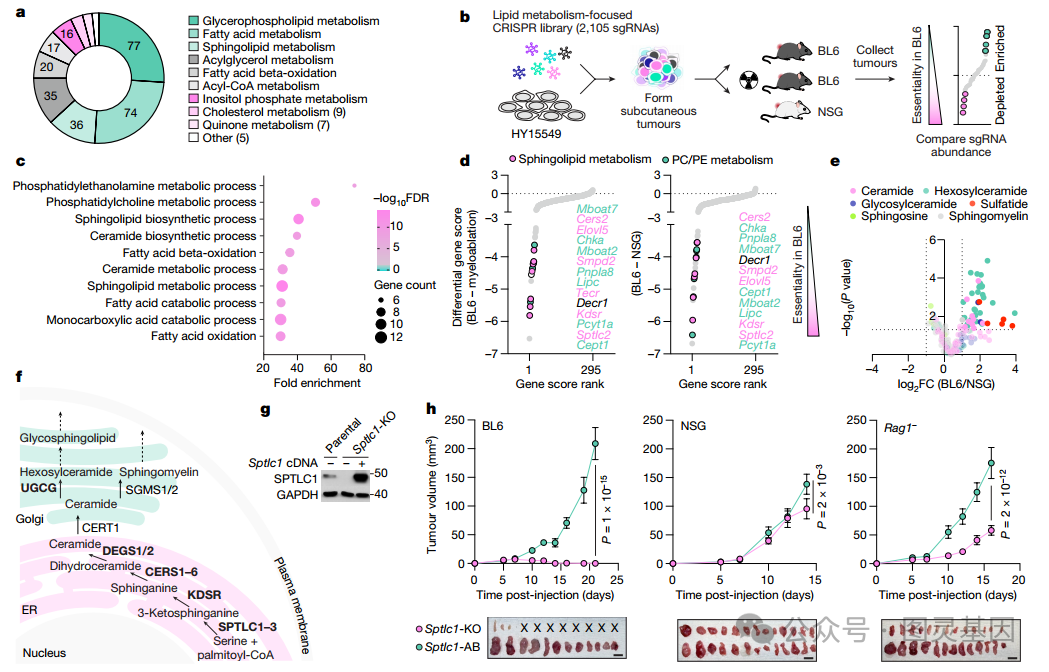
研究者使用 HY15549( 一种 KRAS 突变小鼠胰腺癌细胞系)转导了靶向 296 个参与脂质代谢途径基因的 sgRNAs( 图 1a) 。随后将其移植到的 C57BL/6J 小鼠、清髓对照组和 NOD-SCID γ 小鼠( NSG 小鼠,体内缺乏成熟 T 、 B 和 NK 细胞)体内 ( 图 1b) 。对各组小鼠肿瘤差异表达基因的 KEGG 通路分析显示, 免疫逃避需要合成膜脂 ,包括鞘脂、磷脂酰胆碱和磷脂酰乙醇胺 ( 图 1c 、 d) 。脂质组学分析显示, 免疫正常小鼠生长的肿瘤中鞘脂显著富集,而免疫缺陷小鼠生长的肿瘤中鞘脂不富集 ( 图 1e) 。
编码新生神经酰胺合成途径中酶的基因 (Sptlc1 、 Sptlc2 、 Kdsr 、 Cers 和 Degs) 和产生所有鞘糖脂前体 (UGCG) 的酶是免疫正常小鼠肿瘤生长所必需的 ( 图 1d) 。神经酰胺是膜鞘脂的前体,调节信号转导、细胞 - 细胞相互作用和膜结构。在研究者的分析中, 鞘氨醇膜糖脂的产生可能与免疫逃避具有较大的相关性 ( 图 1f) 。
随后研究者敲除了 Sptlc1 基因并且使用了表达 sgRNA 抗性的等基因对抗性细胞,并证实了敲除细胞中脂类物质的消耗 ( 图 1g) 。 SPT 缺失后在体外观察到的鞘脂耗竭在免疫正常小鼠的肿瘤细胞中部分重现。鞘脂合成的缺失严重损害了 C57BL/6J 小鼠的肿瘤生长,但在 NSG 小鼠中不影响。 Sptlc1 缺失部分影响 Rag1− 小鼠的肿瘤生长( Rag1− 小鼠缺乏成熟的 T 细胞和 B 细胞), 这表明适应性和先天免疫系统都有助于 Sptlc1-KO 或 Sptlc2-KO 肿瘤的肿瘤监测 ( 图 1h) 。
图 1. 鞘脂合成在癌症免疫逃避中的重要作用
3. 鞘脂合成保护癌细胞免受免疫细胞的抗肿瘤作用
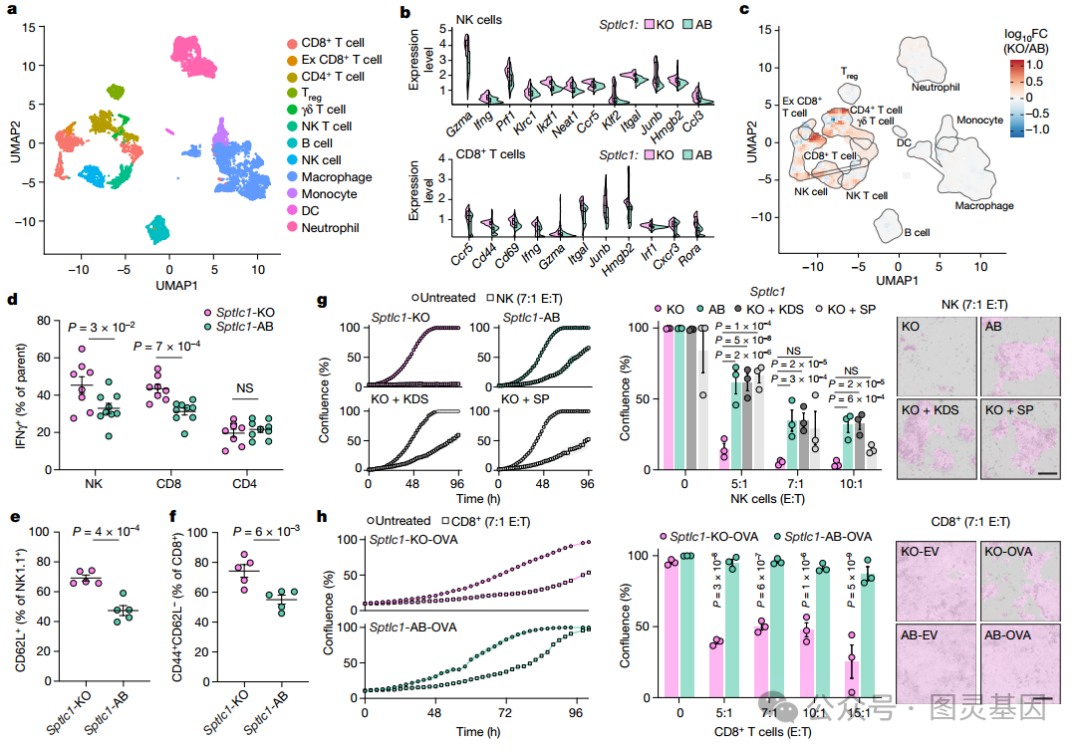
研究者对 C57BL/6J 小鼠生长的 Sptlc1-KO 和 Sptlc1-addback (AB) 肿瘤中分离的 CD45+ 免疫细胞进行了 scRNA-seq 。实验结果表明 Sptlc1-KO 肿瘤中浸润淋巴细胞的比例没有发生重大变化 ( 图 2a) 。但来自 Sptlc1-KO 肿瘤的 NK 和 CD8+ T 细胞上调了与激活和细胞毒性状态相关的基因,如干扰素 -γ (IFNγ)( 图 2b,c) 。
流式细胞术分析证实,肿瘤中 Sptlc1 缺失后, NK 和 CD8+ T 细胞的激活状态升高, IFNγ 表达增加 ( 图 2d-f) 。总之,这些结果表明, 癌细胞鞘脂的消耗改变了 TME 中细胞毒性淋巴细胞的功能状态 。
为了进一步了解 NK 和 CD8+ T 细胞是否直接参与抑制鞘脂合成缺陷癌细胞的生长,研究者将 Sptlc1-KO 和 Sptlc1-AB 细胞分别与 C57BL/6J 和 OT-1 小鼠分离的 NK 或 CD8+ T 细胞共培养。 Sptlc1-KO 细胞对 NK 细胞的抗增殖作用更敏感,补充 3- 酮鞘氨酸或鞘氨醇足以挽救这种作用 ( 图 2g) 。
同样,与 Sptlc1-AB 对照相比, CD8+ T 细胞以抗原特异性的方式更有效地抑制 Sptlc1-KO 癌细胞的生长 ( 图 2h) 。因此,这些结果表明, 新生鞘脂合成可以保护癌细胞免受 NK 和 CD8+ T 细胞的免疫监视 。
图 2. 肿瘤鞘脂抑制细胞毒性免疫
4. 鞘脂耗竭增强 IFNγ 信号传导
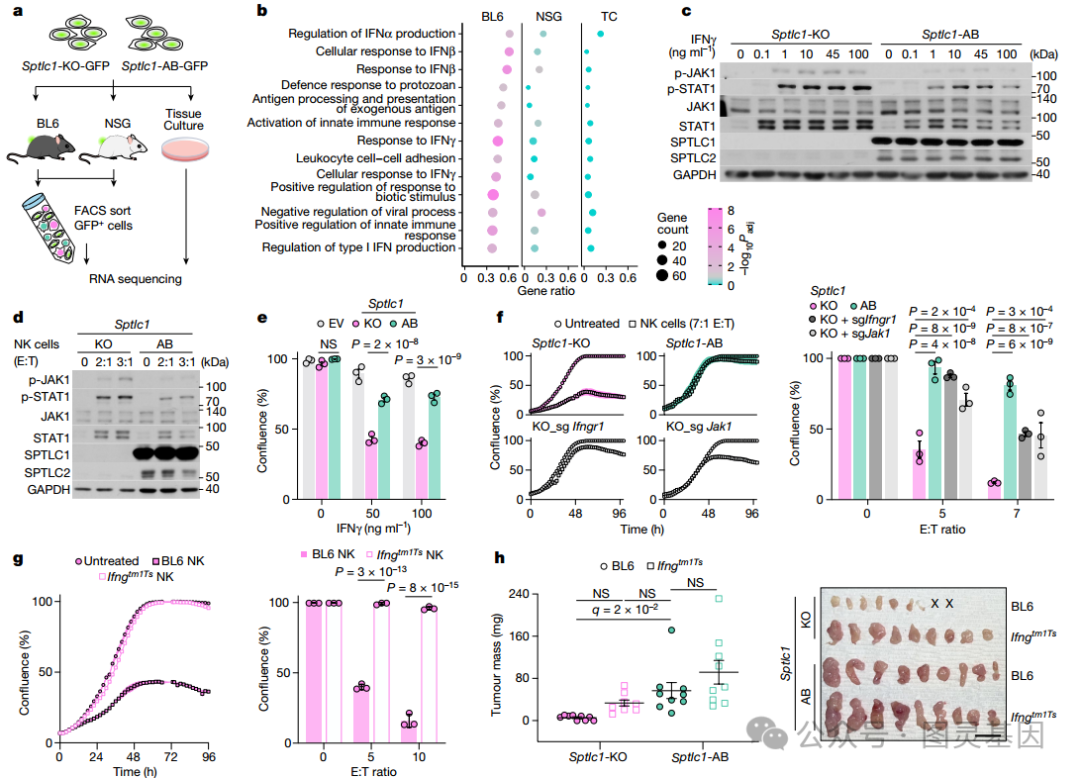
接下来,研究者试图确定癌症鞘脂介导 NK 和 CD8+ T 细胞免疫逃避的机制。研究者比较了体外培养或从 C57BL/6J 或 NSG 小鼠生长的肿瘤中分离的 Sptlc1-KO 和 Sptlc1-AB 胰腺癌细胞的转录组 ( 图 3a) 。基因集富集分析显示,在免疫监视的存在下, Sptlc1-KO 细胞上调了参与干扰素信号传导和应答途径的基因的表达 ( 图 3b) 。这表明 新生鞘脂合成丧失可能通过干扰素信号传导促进肿瘤细胞敏感性 。
鞘脂合成的缺失在胰腺癌细胞暴露于 IFNγ 或 NK 细胞时增加了 JAK1 和 STAT1 的磷酸化和表达 ( 图 3c,d) 。同时,鞘脂合成的抑制使 HY15549 细胞对 IFNγ 介导的生长停滞敏感 ( 图 3e) 。
通过 CRISPR 介导的 Ifngr1 或 Jak1 缺失, IFNγ 在 Sptlc1-KO 细胞中的抗增殖作用得以恢复 ( 图 3f) ,缺乏 IFNγ 的 NK 细胞对 Sptlc1-KO 细胞的生长没有抑制作用 ( 图 3g) 。在 IFNγ- 缺陷 (Ifngtm1Ts) 小鼠中, Sptlc1 缺失的抗肿瘤作用被部分消除,这表明 肿瘤鞘脂保护癌细胞免受宿主 IFNγ 信号的影响 ( 图 3h) 。
图 3. 鞘脂合成缺失使癌细胞对 IFNγ 敏感
5. 鞘脂合成缺失通过破坏 IFNGR1 表面表达而使细胞对 IFNγ 敏感
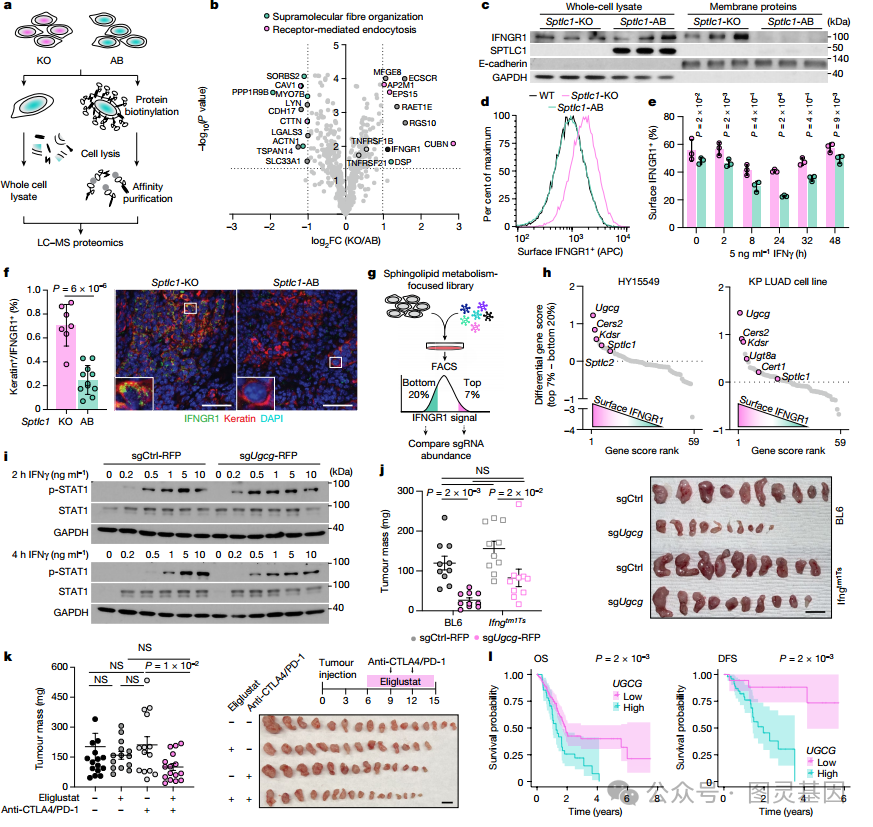
鞘糖脂影响膜 IFNGR1
随后研究者试图确定鞘脂合成的缺失是否会影响特定膜蛋白的功能或表达。研究者对从 Sptlc1-KO 和 Sptlc1-AB 胰腺癌细胞中分离的全细胞和质膜蛋白进行了平行蛋白质组学分析 ( 图 4a) 。结果显示:与 Sptlc1- AB 对照相比, Sptlc1-KO 细胞的膜蛋白丰度发生了实质性变化 ( 图 4b) 。特别是,在 Sptlc1-KO 细胞中, IFNGR1 得到上调。
因此,研究者测试了鞘脂合成的缺失是否可能通过破坏 IFNGR1 表面表达而使细胞对 IFNγ 敏感。 Sptlc1-KO 细胞和 AB 细胞的免疫印迹和流式细胞术分析显示 IFNGR1 表面表达在鞘脂耗竭细胞中的丰度 ( 图 4c-e) 。同时,对 C57BL/6J 小鼠生长的 Sptlc1-KO 和 Sptlc1-AB 肿瘤组织样本的分析显示,鞘脂合成的缺失显著增加了体内 IFNGR1 的表达 ( 图 4f) 。
为了确定哪些神经酰胺衍生的脂质会影响 IFNGR1 的水平,研究者在 HY15549 和 KP LUAD 细胞中使用鞘脂代谢聚焦的 CRISPR 文库进行了筛选 ( 图 4g) 。得分最高的基因之一是 udp - 葡萄糖神经酰胺葡萄糖基转移酶 (UGCG) ,它是催化神经酰胺转化为鞘糖脂的第一步关键酶 ( 图 4h) 。 表明鞘糖脂合成在介导 IFNGR1 表面表达中起作用 。
鞘糖脂损失增强免疫治疗
鞘糖脂消耗增加了免疫正常小鼠肿瘤对 IFNγ 的敏感性和生长受损 ( 图 4i) 。在 IFNγ 缺乏的小鼠中, UGCG 缺失的抗肿瘤作用部分消失,这表明鞘糖脂部分保护癌细胞免受 IFNγ 介导的肿瘤控制 ( 图 4j) 。
接下来,研究者使用了一种 UGCG 的小分子抑制剂 ——Eliglustat 。研究者用 Eligustat 和检查点阻断疗法 (CBT) 联合治疗 HY15549 或 KP LUAD 荷瘤免疫活性小鼠。结果显示 Eligustat 治疗与双重 CBT 治疗协同作用可显著减轻肿瘤负担 ( 图 4k) 。最后,研究者对 TCGA-PanCanAtlas 数据集分析显示,在 PDAC 患者中, UGCG 的高表达与疾病严重程度之间存在显著相关性 ( 图 4l) 。
图 4. 鞘脂合成缺失通过破坏 IFNGR1 表面表达而使细胞对 IFNγ 敏感
6 、未来研究方向
本文揭示了鞘糖脂的合成是 KRAS 驱动的癌细胞免疫逃避的关键内源性限制。但是最近的研究中通过系统的体内 CRISPR 筛选显示鞘脂合成并不是肿瘤生长的普遍必要条件。未来的工作需要确定这种策略是否仅限于 KRAS 突变肿瘤,还是可以推广到其他类型的癌症。
从本文的研究结果来看,膜鞘脂糖的增加可能被用于预测癌症进展和患者对免疫治疗的反应,血清鞘磷脂和鞘糖脂水平升高可能预示着癌症的进展。通过药物或饮食干预改变鞘脂膜组成也可能是改善免疫治疗反应的可行策略。
教授介绍
Kıvanç Birsoy 教授,美国洛克菲勒大学(美国第一个生物医学研究中心)代谢调节与遗传实验室的资深教授,其研究领域主要集中于肿瘤代谢研究和细胞器研究中,尤其是线粒体健康机制的研究。于 Nature 、 Science 等顶刊上发表了数篇高质量的文章。
参考文献
Soula M, Unlu G, Welch R,et al. Glycosphingolipid synthesis mediates immune evasion in KRAS-drivencancer. Nature. Published online August 7, 2024. doi:10.1038/s41586-024-07787-1
链接:http://www.lewenyixue.com/2024/08/13/Nature%20%EF%BD%9C%20%E5%85%8D%E7%96%AB%E9%80%83%E9%80%B8%E7%AB%9F%E4%B8%8E%E8%84%82%E8%B4%A8%E6%9C%89%E5%85%B3%EF%BC%81/








 知道|国家药品不良反应监测年度报告(2024年)
知道|国家药品不良反应监测年度报告(2024年)
赶快来坐沙发