J Clin Invest | L-2HG:肾癌治疗新靶点,饮食调整或成抗癌新策略
【CMT&CHTV 文献精粹】
导语 :肾细胞癌(Renal Cell Carcinoma, RCC)的治疗方式虽然已不断得到丰富和发展,但对肿瘤生物学的深入理解仍然不足,特别是肿瘤细胞如何通过代谢重编程来支持其生长和存活。近年来,肿瘤代谢领域的研究揭示了一类特殊的小分子——癌代谢物(Oncometabolite),在肿瘤细胞内的异常积累可能对肿瘤生长具有促进或抑制作用。然而,此类代谢物如何影响肿瘤细胞的代谢途径,以及如何开发针对这些代谢物的治疗策略,仍需进一步探索。
2024年5月, The Journal of Clinical Investigation 杂志发表了题为“L-2-Hydroxyglutarate remodeling of the epigenome and epitranscriptome creates a metabolic vulnerability in kidney cancer models”的研究,不仅在分子层面上揭示了L-2HG对肿瘤细胞代谢的影响,还在细胞和整体动物层面上验证了其生物学功能和潜在的治疗价值。

研究方法
该研究是一项多学科交叉的综合性研究,旨在探索L-2HG在肾癌发展中的作用及其对肿瘤细胞代谢的影响。研究团队采用了包括体外细胞培养、体内动物模型、分子生物学技术、表观遗传学分析、代谢组学分析和生物信息学工具在内的多种研究方法。
在体外实验部分,研究者使用了人肾癌细胞系,通过CRISPR/Cas9基因编辑技术敲除L2HGDH基因,构建了L-2HG水平升高的细胞模型。同时,通过转染L2HGDH cDNA的方式恢复了部分细胞的L-2HG水平,以此模拟L-2HG水平变化对肿瘤细胞的影响。研究中还包括了使用特定siRNA进行基因敲减,以及通过添加外源性L-2HG来升高细胞内L-2HG水平的实验。
体内实验部分,研究者利用了免疫缺陷的小鼠模型,通过皮下注射不同处理的肾癌细胞建立肿瘤异种移植模型,评估L-2HG水平变化对肿瘤生长的影响。此外,研究者还通过改变小鼠的饮食组成,特别是去除饮食中的丝氨酸和甘氨酸(SerGly),来模拟体内丝氨酸剥夺条件,进一步观察肿瘤细胞对外源性丝氨酸的依赖性。
分子机制探索方面,运用了RNA测序(RNA-Seq)和m6A测序(m6A-Seq)技术,全面分析了L-2HG对肿瘤细胞转录组和表观转录组的影响。此外,通过实时定量PCR(RT-qPCR)、免疫印迹(Immunoblotting)和酶联免疫吸附试验(ELISA)等方法,研究者对特定基因和蛋白的表达水平进行了定量分析。
代谢组学分析方面,使用了液相色谱-质谱联用技术(LC-MS)对细胞和组织样本中的代谢物进行了定量和定性分析,以揭示L-2HG对肿瘤细胞代谢途径的影响。此外,研究者还使用了基于荧光素酶报告基因的翻译效率分析,评估了L-2HG对特定mRNA翻译后修饰的影响。
研究结果
研究结果显示,在l-2HG水平升高的RCC细胞中,与氨基酸代谢相关的基因表达明显降低,特别是丝氨酸生物合成途径中的关键酶PHGDH和PSAT1。通过降低l-2HG水平,可以恢复这些基因的表达,进而促进丝氨酸的内源性合成。此外,研究发现高l-2HG水平的肿瘤细胞对外界丝氨酸的依赖性增加,限制丝氨酸的可用性可以抑制这些肿瘤细胞的增殖和肿瘤生长。在动物模型中,通过饮食限制丝氨酸和甘氨酸,可以显著减缓高l-2HG RCC肿瘤的生长。这些结果为开发针对丝氨酸代谢途径的肿瘤治疗策略提供了新的理论基础。
L-2HG在肾癌中的代谢重编程作用
研究的核心发现是L-2HG在肾癌中的代谢重编程作用。研究发现,L-2HG水平的升高导致肿瘤细胞对氨基酸代谢途径的重塑,特别是对丝氨酸生物合成途径的影响。通过降低L-2HG水平,可以显著增加与氨基酸代谢相关的mRNA表达,包括PHGDH和PSAT1,这些酶是丝氨酸生物合成途径中的关键酶。具体数据显示,L2HGDH恢复后,PHGDH和PSAT1的mRNA水平分别增加了2.5倍和1.8倍(图1.A)。
L-2HG对丝氨酸生物合成途径的抑制
研究进一步揭示了L-2HG对丝氨酸生物合成途径的抑制作用。通过CRISPR/Cas9技术敲除L2HGDH基因,导致L-2HG水平升高,与此相应的是PHGDH和PSAT1 mRNA水平的显著降低。此外,外源性L-2HG的添加同样降低了PHGDH的蛋白表达,证实了L-2HG对丝氨酸生物合成途径的直接抑制作用(图1K)。

图1 高1-2HG抑制RCC 中的氨基酸合成和转运蛋白基因
L-2HG对m6A修饰的影响及其在肿瘤细胞中的功能
L-2HG对mRNA m6A修饰水平的影响是本研究的另一重要发现。研究表明,降低L-2HG水平可以显著降低mRNA m6A修饰水平,这一效应依赖于L2HGDH的催化活性。此外,L-2HG能够促进PSAT1 mRNA 3'-UTR区域的m6A修饰,导致PSAT1蛋白表达降低。通过敲除m6A甲基转移酶复合体的催化亚单位METTL3,可以增加PSAT1蛋白的表达,而敲除m6A去甲基化酶ALKBH5则降低了PSAT1的表达,表明L-2HG通过m6A修饰调控PSAT1的表达(见图2)。
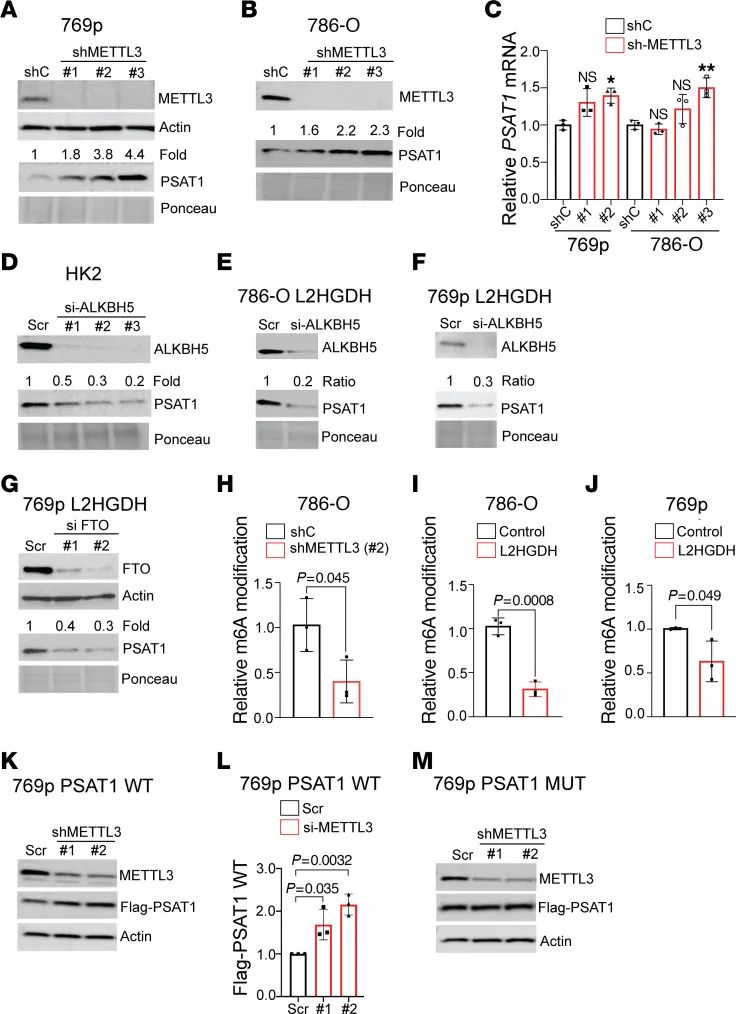
图2 L-2HG对m6A修饰的影响
L-2HG导致的肿瘤细胞对外源性丝氨酸的依赖性
研究结果表明,L-2HG水平的升高导致肿瘤细胞对外源性丝氨酸的依赖性增强。在L2HGDH恢复的细胞中,即使在丝氨酸和甘氨酸(SerGly)被剥夺的条件下,肿瘤细胞的增殖能力也未受到显著影响,而在L-2HG水平较高的细胞中,SerGly的剥夺显著降低了细胞的增殖能力(见图3)。此外,体内实验也证实了这一点,即在缺乏SerGly的饮食条件下,高L-2HG水平的肿瘤细胞生长受到抑制。
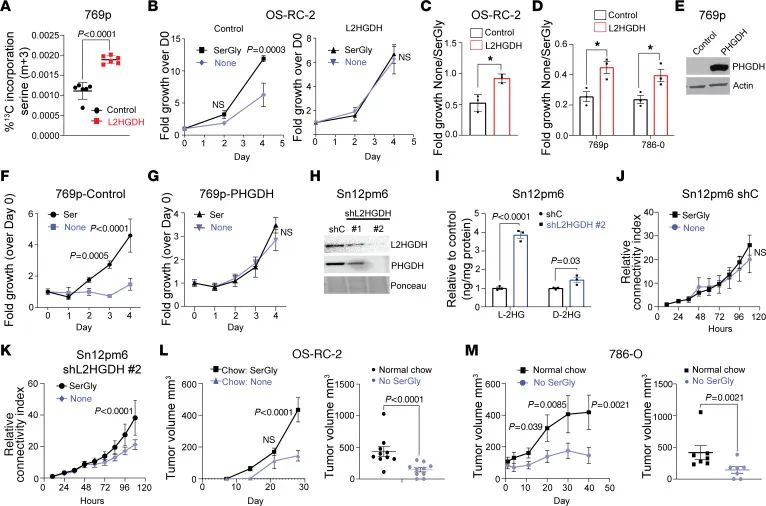
图3.高1-2HG导致RCC细胞系出现外源性丝氨酸依赖性
L-2HG对肿瘤细胞氧化还原平衡的影响
L-2HG对肿瘤细胞氧化还原平衡的影响是本研究的又一重要结论。研究发现,L-2HG水平较高的肿瘤细胞在缺乏SerGly的条件下,对氧化应激的敏感性增加,而L2HGDH恢复的细胞则能够维持氧化还原平衡,抵抗氧化应激(见图4)。
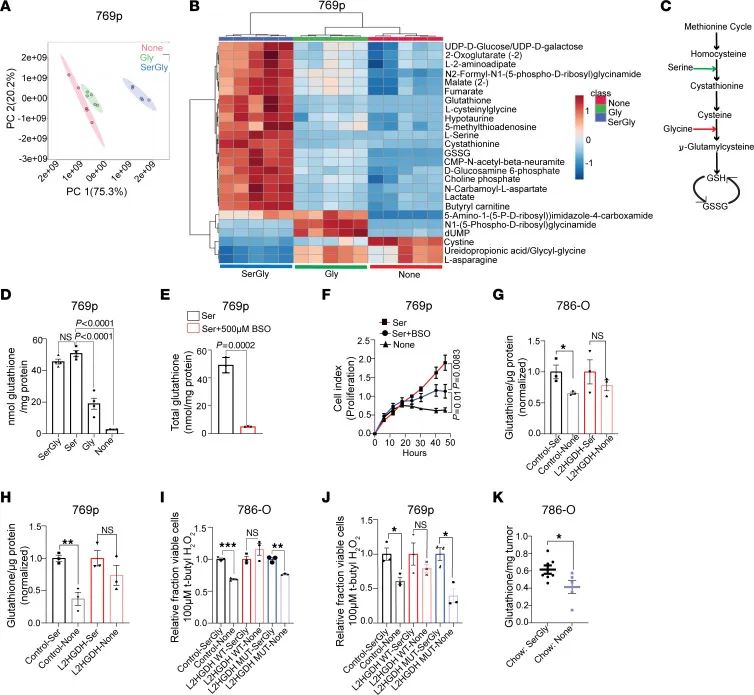
图6.RCC 中谷胱甘肽合成-外源丝氨酸
讨论与总结
本研究揭示了l-2HG在RCC中的特异作用,并发现了通过调节丝氨酸代谢来治疗RCC的潜在新策略。特别是,通过限制丝氨酸的可用性来治疗肿瘤的概念,为开发新的饮食干预或药物靶向疗法提供了可能。此外,这项研究还强调了代谢物在肿瘤发展中的复杂作用,提示我们在未来的肿瘤治疗中需要更多地考虑肿瘤细胞的代谢特性。
参考文献
KUNDU A, BRINKLEY G J, NAM H, et al. l-2-Hydroxyglutarate remodeling of the epigenome and epitranscriptome creates a metabolic vulnerability in kidney cancer models[J]. J Clin Invest, 2024, 134(13): e171294. DOI: 10.1172/JCI171294.
参考文献
HAGE CHEHADE C, AGARWAL N. Molecular subtypes as potential biomarkers in renal cell carcinoma[J]. Cancer Cell. 2024, 42(5):736-738. doi:10.1016/j.ccell.2024.04.003
编辑:且行
二审:耳东
三审:清扬
排版:半夏
封面图源:Pexels
链接:http://www.lewenyixue.com/2024/08/13/J%20Clin%20Invest%20%7C%20L-2H/