增强对放化疗的敏感性!《细胞》子刊:胶质母细胞瘤有望迎来靶向药物
-
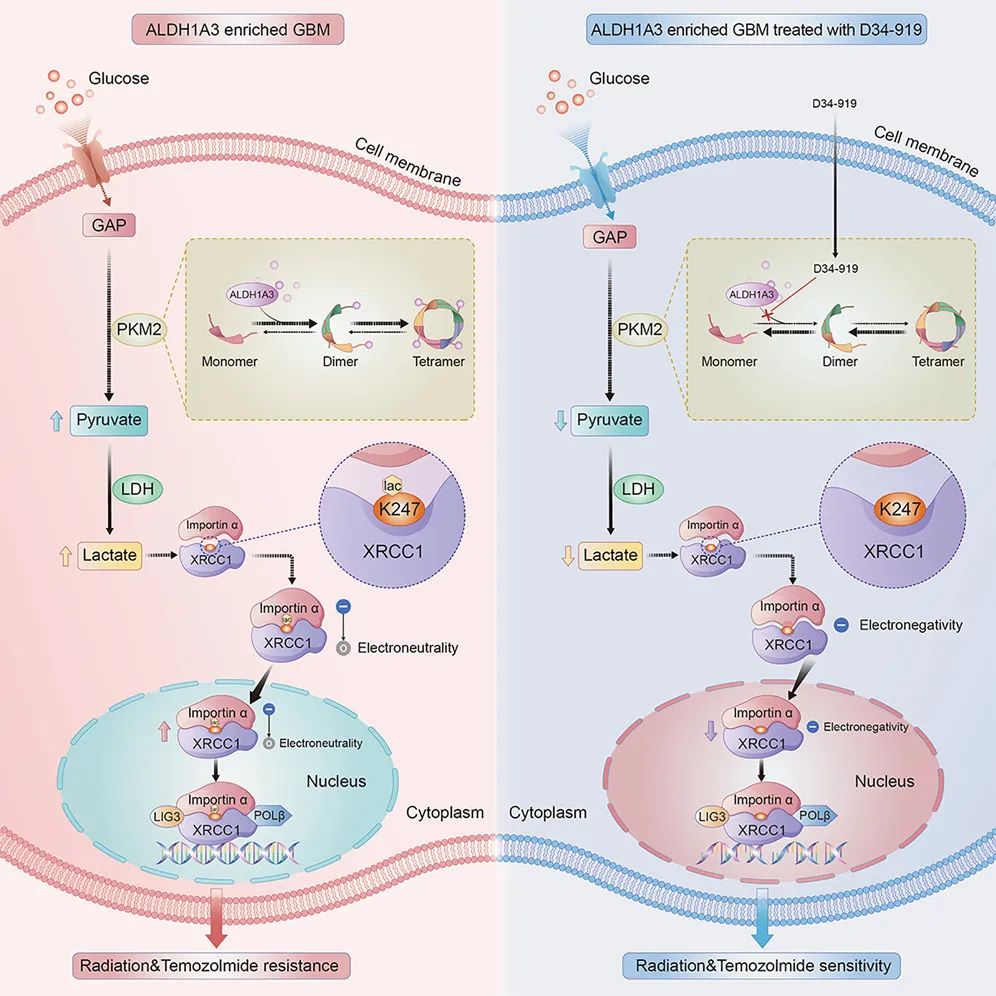
研究 首次阐明了胶质瘤干细胞生物标志物ALDH1A3,通过别构激活糖酵解通路关键酶PKM2,介导胶质母细胞瘤葡萄糖代谢重编程并导致乳酸堆积的分子机制 ; -
研究证实细胞内堆积的乳酸可促使DNA损伤修复相关蛋白XRCC1发生乳酰化修饰和核转运增加,最终介导胶质母细胞瘤的放化疗抵抗; -
该研究还基于高通量小分子药物筛选平台鉴定出 靶向PKM2别构激活位点的小分子抑制剂——D34-919 ,并通过体内外模型证实D34-919药物可以阻断ALDH1A3与PKM2互作,逆转ALDH1A3介导的糖酵解异常激活,抑制肿瘤细胞DNA损伤修复,从而增强胶质母细胞瘤对放化疗的敏感性。

首都医科大学附属北京天坛医院主治医师李冠璋与博士研究生王地为共同第一作者,首都医科大学附属北京天坛医院神经外科学中心江涛院士与张伟教授(末位通讯)为共同通讯作者。
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/08/13/%E5%A2%9E%E5%BC%BA%E5%AF%B9%E6%94%BE%E5%8C%96%E7%96%97%E7%9A%84%E6%95%8F%E6%84%9F%E6%80%A7%EF%BC%81%E3%80%8A%E7%BB%86%E8%83%9E%E3%80%8B%E5%AD%90%E5%88%8A%EF%BC%9A%E8%83%B6%E8%B4%A8/
链接:http://www.lewenyixue.com/2024/08/13/%E5%A2%9E%E5%BC%BA%E5%AF%B9%E6%94%BE%E5%8C%96%E7%96%97%E7%9A%84%E6%95%8F%E6%84%9F%E6%80%A7%EF%BC%81%E3%80%8A%E7%BB%86%E8%83%9E%E3%80%8B%E5%AD%90%E5%88%8A%EF%BC%9A%E8%83%B6%E8%B4%A8/
THE END