Mol Cancer丨2篇!山东大学杨其峰等团队合作发现编码环状DNA在乳腺癌化学耐药性和转移中的作用机理
近期,人们认识到由环状RNA的非规范开放阅读框(ORF)编码的肽和蛋白质在疾病进展中起着重要作用,但这些肽和蛋白质的生物学功能和机制在很大程度上尚不清楚。
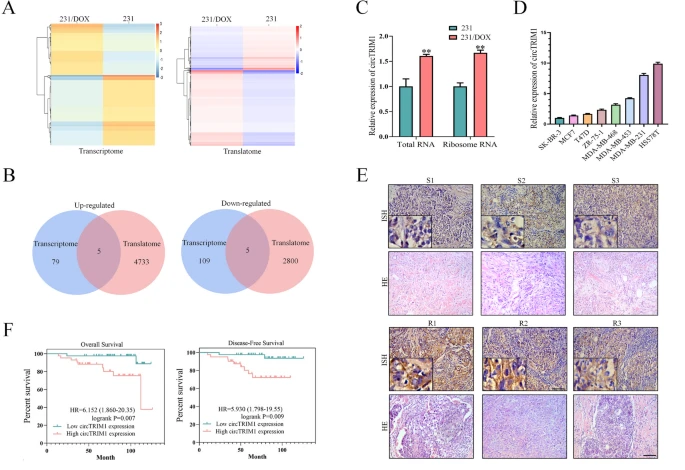
2024年5月16日,山东大学杨其峰及中国科学院上海营养与健康研究所胡国宏共同通讯在 Molecular Cancer 在线发表题为 “ CircTRIM1 encodes TRIM1-269aa to promote chemoresistance and metastasis of TNBC via enhancing CaM-dependent MARCKS translocation and PI3K/AKT/mTOR activation ”的研究论文。 该研究通过交叉转录组和翻译组RNA测序数据,确定了一个潜在的编码环状RNA,circTRIM1,它在阿霉素耐药的TNBC细胞中上调,并且它的表达与TNBC患者的临床病理特征和不良预后相关。
CircTRIM1具有功能性IRES元素以及810ntORF,可以翻译成一种称为TRIM1-269aa的新型内源表达蛋白。功能上,作者证明参与circTRIM1生物学功能的TRIM1-269aa在体内和体外均促进了TNBC细胞的化学耐药性和转移。此外,作者发现TRIM1-269aa可以包装到外泌体中并在TNBC细胞之间传播。从机制上讲,TRIM1-269aa增强了MARCKS与钙调蛋白之间的相互作用,从而促进了钙调蛋白依赖性的MARCKS易位,进一步启动了PI3K/AKT/mTOR通路的激活。总体而言,编码TRIM1-269aa的circTRIM1通过增强MARCKS易位和PI3K/AKT/mTOR激活来促进TNBC的化学耐药性和转移。 该研究对蛋白质编码环状RNA的作用产生了新的见解,并支持将circTRIM1/TRIM1-269aa作为TNBC患者新的有希望的预后和治疗靶点。
另外, 2024年6月8日,山东大学杨其峰团队在 Molecular Cancer 在线发表题为 “ Exosomal circSIPA1L3-mediated intercellular communication contributes to glucose metabolic reprogramming and progression of triple negative breast cancer ” 的研究论文, 该研究通过RNA-seq分析,circSIPA1L3被确定为能量应激后代谢适应的关键介质。功能获得和丧失实验表明,circSIPA1L3对乳腺癌进展和糖酵解具有刺激作用,并且可以通过外泌体运输并促进乳腺癌细胞的恶性行为。 值得注意的是,circSIPA1L3介导的糖酵解增强引起的乳酸分泌增加促进了肿瘤相关巨噬细胞的募集及其促癌作用。临床上,根据238名乳腺癌患者队列,circSIPA1L3表达升高预后不良。此外,circSIPA1L3在乳腺癌患者血清中高表达,对乳腺癌患者具有很高的诊断价值。 研究强调了circSIPA1L3通过介导葡萄糖代谢的致癌作用,这可能成为乳腺癌有希望的诊断和预后生物标志物和潜在的治疗靶点 ( 点击阅读 )。
 乳腺癌是一种严重威胁女性健康的疾病,全球每年都有大量女性死于乳腺癌。 根据国际癌症研究机构(IARC)的最新报告,2020年全球乳腺癌新发病例增至226万,首次超过肺癌,成为全球第一大恶性肿瘤。乳腺癌具有明显的异质性,约15%–20%的乳腺癌患者为三阴性乳腺癌(TNBC),其特征是雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2型(Her-2)基因表达缺失。作者前期研究结果表明,由于转移早、增殖快、缺乏有效治疗的分子靶点等因素,TNBC患者的预后相对较差。 虽然手术和放疗是治疗TNBC患者的常用方法,但辅助化疗似乎对于解决分子靶点的缺失尤为重要,从而成为唯一的全身治疗选择。
与非TNBC亚型相比,TNBC亚型对化疗更敏感,尤其是对蒽环类和紫杉烷类等细胞毒药物。 一项现实世界研究表明,在8.2年的中位随访中,化疗显著提高了TNBC患者的总生存率(调整后的HR=0.58,95%CI=0.46–0.73)和乳腺癌特定生存率(调整后的HR=0.65,95%CI=0.48–0.89)。然而值得注意的是,TNBC细胞比其他类型的乳腺癌更容易产生化学耐药性,大多数TNBC患者最终都会产生化学耐药性。化疗耐药性的获得是一个复杂的过程,由多种机制启动,包括细胞凋亡减少和自噬调节。一旦发生化疗耐药,癌细胞就会变得更具侵袭性和转移性,这是导致临床患者治疗失败、疾病复发和最终死亡的最普遍因素。 因此,迫切需要阐明TNBC化疗耐药和转移的分子机制并确定新的靶点。
CircTRIM1是DOX耐药性TNBC中上调的circRNA,具有转化和预后潜力(图源自 Molecular cancer )
新一代测序技术的进步使得越来越多以前未被发现的转录本得以鉴定。 环状RNA(circRNA)是一类新认识的内源性RNA转录本,由于前mRNA转录本的非连续反向剪接而具有共价闭环结构,最初被误解为剪接错误的副产物。 与线性RNA不同,circRNA不具有5'帽子或3'尾巴,并表现出不同特征,例如半衰期更长,进化保守性更高,对RNaseR消化的抵抗力更强。虽然之前大多数研究都集中在circRNA的非编码作用,但值得注意的是,大多数circRNA来自宿主基因的编码外显子,其中大多数含有可翻译的开放阅读框(ORF)。 此外,circRNA主要定位于细胞质中,它们可以与核糖体结合并启动翻译,因为大多数circRNA都含有IRES。
例如,circPPP1R12A可以通过激活Hippo–YAP信号通路促进结肠癌的发病和转移。circ-AKT3通过抑制AKTThr308的磷酸化来抑制胶质母细胞瘤细胞的增殖、放射抗性和体内致瘤性。作者还报道了circ-EIF6编码EIF6-224aa通过激活Wnt/β-catenin通路促进TNBC的增殖和转移。 然而,蛋白质编码circRNA在TNBC化学抗性和进展中的功能和潜在机制仍未得到充分探索,鉴定在TNBC中起致癌作用的新型蛋白质编码circRNA并阐明其潜在机制可能为TNBC治疗提供新的治疗靶点。
在本研究中,作者通过转录组和翻译组RNA测序鉴定了一个未发表的circRNA,hsa_circ_0002153(也称为circTRIM1),它在DOX耐药的TNBC细胞和组织中上调。 circTRIM1的表达还与TNBC患者的临床病理特征和不良预后有关。进一步的实验表明,circTRIM1可以以IRES依赖的方式翻译成一种称为TRIM1-269aa的新蛋白质。 体外和体内研究表明,circTRIM1通过编码TRIM1-269aa促进TNBC细胞的化学耐药性和转移。
此外,TRIM1-269aa可以被封装在外泌体中,从而通过外泌体传输发挥其功能。从机制上看,TRIM1-269aa增强了MARCKS与钙调蛋白的相互作用,进而促进了钙调蛋白依赖性的MARCKS易位。易位的MARCKS可进一步激活下游的PI3K/AKT/mTOR通路,导致TNBC细胞的恶性行为。 总之,作者的研究表明,circTRIM1编码的TRIM1-269aa通过增强钙调蛋白依赖性的MARCKS易位和PI3K/AKT/mTOR激活来促进TNBC的化疗耐药和转移。
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-024-02019-6
乳腺癌是一种严重威胁女性健康的疾病,全球每年都有大量女性死于乳腺癌。 根据国际癌症研究机构(IARC)的最新报告,2020年全球乳腺癌新发病例增至226万,首次超过肺癌,成为全球第一大恶性肿瘤。乳腺癌具有明显的异质性,约15%–20%的乳腺癌患者为三阴性乳腺癌(TNBC),其特征是雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2型(Her-2)基因表达缺失。作者前期研究结果表明,由于转移早、增殖快、缺乏有效治疗的分子靶点等因素,TNBC患者的预后相对较差。 虽然手术和放疗是治疗TNBC患者的常用方法,但辅助化疗似乎对于解决分子靶点的缺失尤为重要,从而成为唯一的全身治疗选择。
与非TNBC亚型相比,TNBC亚型对化疗更敏感,尤其是对蒽环类和紫杉烷类等细胞毒药物。 一项现实世界研究表明,在8.2年的中位随访中,化疗显著提高了TNBC患者的总生存率(调整后的HR=0.58,95%CI=0.46–0.73)和乳腺癌特定生存率(调整后的HR=0.65,95%CI=0.48–0.89)。然而值得注意的是,TNBC细胞比其他类型的乳腺癌更容易产生化学耐药性,大多数TNBC患者最终都会产生化学耐药性。化疗耐药性的获得是一个复杂的过程,由多种机制启动,包括细胞凋亡减少和自噬调节。一旦发生化疗耐药,癌细胞就会变得更具侵袭性和转移性,这是导致临床患者治疗失败、疾病复发和最终死亡的最普遍因素。 因此,迫切需要阐明TNBC化疗耐药和转移的分子机制并确定新的靶点。
CircTRIM1是DOX耐药性TNBC中上调的circRNA,具有转化和预后潜力(图源自 Molecular cancer )
新一代测序技术的进步使得越来越多以前未被发现的转录本得以鉴定。 环状RNA(circRNA)是一类新认识的内源性RNA转录本,由于前mRNA转录本的非连续反向剪接而具有共价闭环结构,最初被误解为剪接错误的副产物。 与线性RNA不同,circRNA不具有5'帽子或3'尾巴,并表现出不同特征,例如半衰期更长,进化保守性更高,对RNaseR消化的抵抗力更强。虽然之前大多数研究都集中在circRNA的非编码作用,但值得注意的是,大多数circRNA来自宿主基因的编码外显子,其中大多数含有可翻译的开放阅读框(ORF)。 此外,circRNA主要定位于细胞质中,它们可以与核糖体结合并启动翻译,因为大多数circRNA都含有IRES。
例如,circPPP1R12A可以通过激活Hippo–YAP信号通路促进结肠癌的发病和转移。circ-AKT3通过抑制AKTThr308的磷酸化来抑制胶质母细胞瘤细胞的增殖、放射抗性和体内致瘤性。作者还报道了circ-EIF6编码EIF6-224aa通过激活Wnt/β-catenin通路促进TNBC的增殖和转移。 然而,蛋白质编码circRNA在TNBC化学抗性和进展中的功能和潜在机制仍未得到充分探索,鉴定在TNBC中起致癌作用的新型蛋白质编码circRNA并阐明其潜在机制可能为TNBC治疗提供新的治疗靶点。
在本研究中,作者通过转录组和翻译组RNA测序鉴定了一个未发表的circRNA,hsa_circ_0002153(也称为circTRIM1),它在DOX耐药的TNBC细胞和组织中上调。 circTRIM1的表达还与TNBC患者的临床病理特征和不良预后有关。进一步的实验表明,circTRIM1可以以IRES依赖的方式翻译成一种称为TRIM1-269aa的新蛋白质。 体外和体内研究表明,circTRIM1通过编码TRIM1-269aa促进TNBC细胞的化学耐药性和转移。
此外,TRIM1-269aa可以被封装在外泌体中,从而通过外泌体传输发挥其功能。从机制上看,TRIM1-269aa增强了MARCKS与钙调蛋白的相互作用,进而促进了钙调蛋白依赖性的MARCKS易位。易位的MARCKS可进一步激活下游的PI3K/AKT/mTOR通路,导致TNBC细胞的恶性行为。 总之,作者的研究表明,circTRIM1编码的TRIM1-269aa通过增强钙调蛋白依赖性的MARCKS易位和PI3K/AKT/mTOR激活来促进TNBC的化疗耐药和转移。
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-024-02019-6

— END—
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/08/05/Mol%20Cancer%E4%B8%A82%E7%AF%87%EF%BC%81%E5%B1%B1%E4%B8%9C%E5%A4%A7%E5%AD%A6%E6%9D%A8%E5%85%B6/
THE END