【CACA周刊】71期 肿瘤免疫治疗超进展
本期看点
序言
作为一种新兴的肿瘤治疗方案,免疫疗法为患者带来了新的希望,一度被誉为“抗癌神药”。但是,“神药”也有发挥失常的时候,免疫疗法的“超进展”成了它们的阿喀琉斯之踵。
注意到,多项免疫疗法对比化疗的大型Ⅲ期研究中,OS曲线都有一个交叉。例如纳武利尤单抗对比多西他赛治疗进展期NSCLC Ⅲ期研究(CheckMate 057):
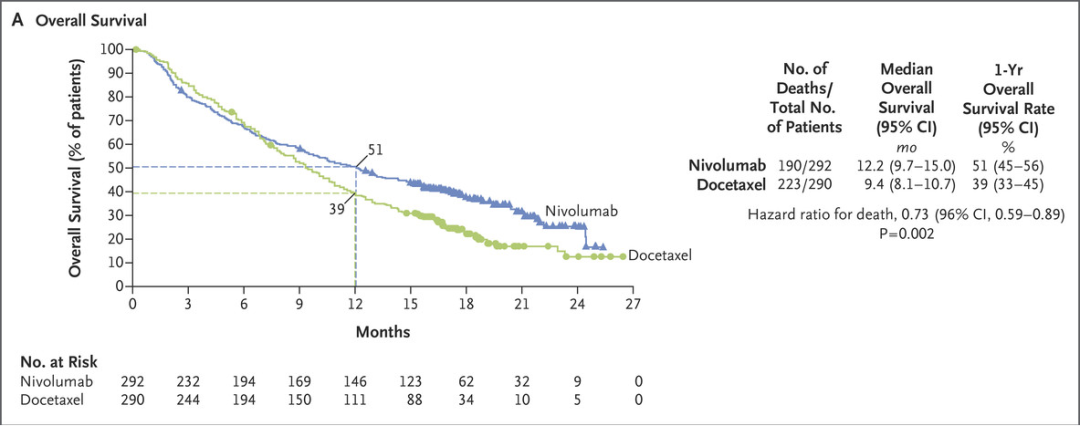
图1
纳武利尤单抗联合伊匹木单抗对比化疗(氟尿嘧啶+顺铂)治疗食管鳞状细胞癌Ⅲ期研究(CheckMate 648):
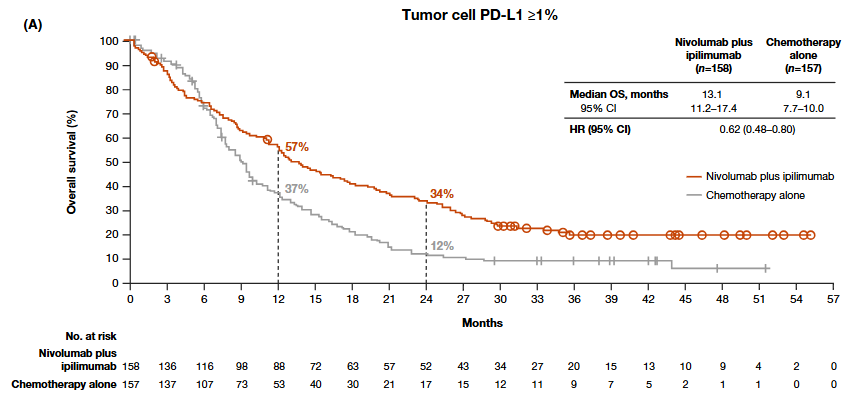
图2
帕博利珠单抗对比多西他赛治疗进展期非小细胞肺癌Ⅲ期研究(KEYNOTE-033):
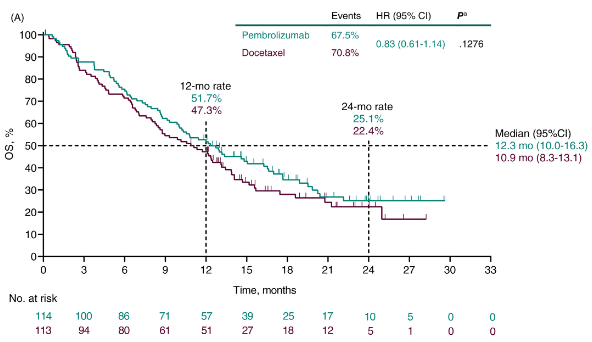
图3
这些研究的OS曲线毫无例外都在初始几个月内存在交叉点,表明免疫疗法的OS获益在初始几个月内不如化疗。这意味着免疫疗法在治疗初期相比化疗更容易出现疾病进展和死亡事件。
同样在CheckMate 648研究中,化疗的加入在一定程度上避免了免疫疗法“超进展”的发生,为患者带来了初期获益。
对照CheckMate 648研究的亚组分析(图2 vs 图4),我们不难发现单用免疫检查点抑制剂对比免疫检查点抑制剂联合化疗,似乎并未在一年OS率上取得显著进展(57% vs 58%),但单用免疫检查点抑制剂的患者明显具有更好的长期生存获益。
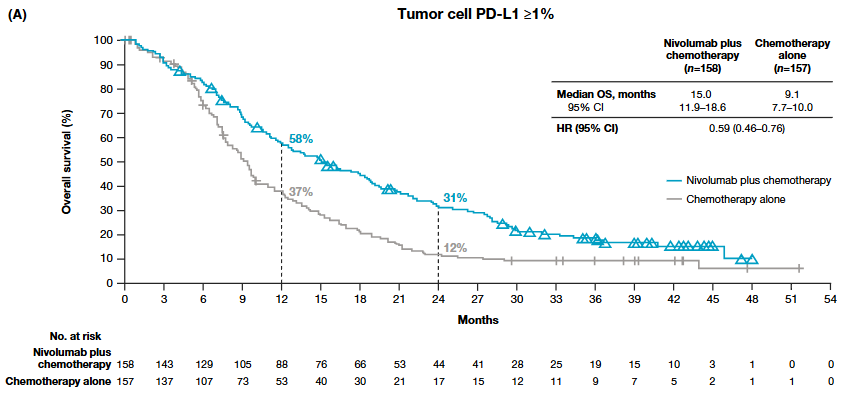
图4
是什么导致了免疫治疗“超进展”?
2016年ESMO大会上,一项研究利用肿瘤生长速率(TGR)的概念细致地对超进展进行了定义:经免疫治疗后病灶体积不减反增,病灶进展较治疗前发展更快(TGR>2),在治疗后第一次评估时肿瘤生长速度的变化与治疗开始前的基线CT扫描相比超过50%,并且预后不佳。
2017年,“ Hyperprogressive Disease Is a New Pattern of Progression in Cancer Patients Treated by Anti-PD-1/PD-L1”指出,研究纳入的131例可评估患者中,12例(9%)被认为患有“超进展”,该进展与基线时较高的肿瘤负荷和肿瘤类型无关,但与较高的年龄和较差结局相关。另外,研究者还观察到,基线时较低的TGR与接受免疫检查点抑制剂治疗后的疾病进展风险相关。
这违背了我们对抗肿瘤治疗效果的常识性认知,似乎是免疫治疗“唤醒”了肿瘤。该研究暗示,抗细胞增殖疗法(如化疗和靶向)和免疫疗法在机制方面具有重要差异。
同年,“ Hyperprogressors after Immunotherapy: Analysis of Genomic Alterations Associated with Accelerated Growth Rate”趁热打铁,指出基因检测可能识别出有“超进展”风险的患者,相关基因包括TP53的“好朋友”——MDM2家族成员和EGFR、cyclin D1、FGF家族成员等。
2023年,“ Intersection of immune and oncometabolic pathways drives cancer hyperprogression during immunotherapy”指出,免疫治疗后“超进展”的患者和CR的患者表现出相当水平的肿瘤浸润CD8 +T细胞浸润和IFNγ表达,但“超进展”的患者相比CR的患者表现出肿瘤FGF2表达和β-catenin信号转导升高。
究其原因,T细胞浸润释放的IFNγ促进肿瘤FGF2信号转导,通过抑制PKM2活性并降低NAD含量,促进SIRT1介导的β-catenin乙酰化,从而增强肿瘤干性。
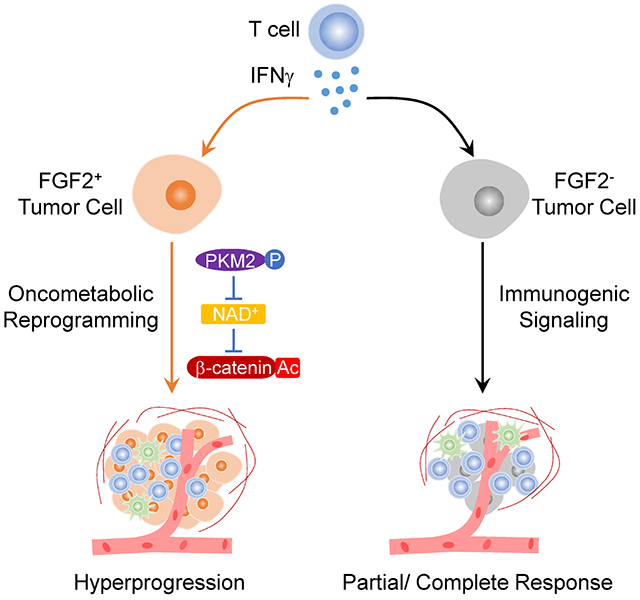
在临床前模型中,靶向IFNγ-PKM2-β-catenin轴已经展现出预防“超进展”的效果。与癌基因成瘾类似,肿瘤细胞也存在“干扰素成瘾”状态,这也意味着我们已经掌握了充足的证据证明肿瘤和T细胞之间存在代谢互相调节,而对于具备FGF2和β-catenin致癌特征的肿瘤患者,免疫激活与免疫治疗期间的“超进展”存在因果关系,这是一种崭新的免疫病理学形式。
当然,临床上也观察到部分患者在接受免疫治疗后出现影像学先进展再缓解的情况,这称之为“假性进展”。目前普遍接受的解释为:激活后的大量免疫细胞向肿瘤内部浸润,导致影像学进展。
如何区分“真假美猴王”成为临床上亟需解决的挑战。目前,随着生物信息学的发展,基因检测、cfDNA检测等一众新技术有望利用相关性分析揪出真正的“六耳猕猴”,而随着我们对细胞信号传导作用于肿瘤发生和发展过程的认识的不断深化,靶向相关靶点必将有助于更好地发挥免疫疗法的抗肿瘤作用,让我们拭目以待!
药事纵横
……
1-
5月14日, EClinicalMedicine :河南省肿瘤医院王启鸣教授公布了信迪利单抗联合安罗替尼作为二线或三线治疗ED-SCLC的研究结果,支持此联合方案用于 ED-SCLC 的进一步研究 [1]。
此项研究招募了接受至少一种铂类化疗的疾病进展的患者。受试者在第一天接受静脉注射信迪利单抗200 mg,在第1~14天每天口服安罗替尼12 mg,每个周期三周。主要终点是PFS,次要终点包括OS、ORR、DCR和安全性。
研究共入组42名患者,其中37例患者可评估疗效。大多数患者的ECOG PS评分为1(31/37,84%)或2(5/37,14%)。24例患者(24/37,65%)初次就诊时为ED-SCLC,而13例(13/37,35%)在进行同步放化疗后复发。大多数患者既往接受过一线治疗(18/37,49%)或二线治疗(18/37,49%),23例患者(23/37,62%)对一线铂类化疗敏感。19例患者(19/37,51%)有脑转移,11例患者(11/37,30%)有肝转移。中位随访时间为24.8个月(IQR:16.9~28.2)。中位PFS为6.1个月(95% CI:5.0~7.3)。OS为12.7个月(95% CI:7.1~18.2)。ORR为56.8%(21/37,95% CI:40.0~73.5),DCR为89.2%(33/37,95% CI:78.7~99.7)。
40例患者(40/42,95%)至少发生1例TRAE。39例患者(39/42,93%)报告了irAE,而11例患者(11/42,26%)报告了3级或更高级别的irAE。最常见的irAE是甲状腺功能减退症(16/42,38%)、γ-谷氨酰转肽酶升高(15/42,36%)和肌酸激酶MB升高(15/42,36%)。最常见的3级或更高级别的irAE是γ-谷氨酰转肽酶升高(5/42,12%)和天冬氨酸转氨酶升高(3/42,7%)。
研究结果显示出信迪利单抗联合安罗替尼具有良好的抗肿瘤活性以及可控的毒性。
2-
5月16日, The New England Journal of Medicine :纳武利尤单抗应用于可切除肺癌的围手术期治疗可进一步改善临床结局 [2]。
研究团队将可切除的ⅡA期成人患者分配到ⅢB NSCLC组,每3周一次接受新辅助纳武利尤单抗加化疗或新辅助化疗加安慰剂,持续4个周期,然后每4周接受一次手术和辅助纳武利尤单抗或安慰剂,持续1年。根据盲法独立评价,主要结局是PFS。根据盲法独立评价,次要结局是pCR和MPR、OS和安全性。
在这项预先指定的中期分析(中位随访,25.4个月)中,纳武利尤单抗组18个月无事件生存的患者百分比为70.2%,化疗组为50.0%(疾病进展或复发、放弃手术或死亡的风险比为0.58;95% CI:0.42~0.81; P <0.001)。纳武利尤单抗组25.3%的患者和化疗组4.7%的患者出现病理学完全缓解(比值比,6.64;95% CI:3.40~12.97);主要病理反应发生率分别为35.4%和12.1%(比值比,4.01;95% CI:2.48~6.49)。
纳武利尤单抗组32.5%的患者发生3级或4级治疗相关不良事件,化疗组25.2%的患者发生3级或4级治疗相关不良事件。
3-
5月16日, EClinicalMedicine :北京大学肿瘤医院沈琳教授报告了ORIENT-15研究中使用信迪利单抗联合化疗对晚期 食管鳞癌 患者健康相关生活质量的影响 [3]。
研究随机化阶段共招募了690名患者,其中341名被分配到信迪利单抗组,349名被分配到安慰剂组。信迪利单抗组57.5%(196/341)的患者,安慰剂组为57.6%(201/349)的患者PD-L1 CPS≥10。入组患者多为男性(85.5%)、亚洲人(93.3%),ECOG PS为1(75.2%);90.7%的患者接受了TP治疗方案。研究使用EORTC QLQ-C30、EORTC QLQ-OES18和EQ-5D-5L的视觉模拟量表(VAS)对所有随机患者进行HRQoL评估。中位随访时间为32.2个月(95% CI:30.78~32.66)。
在QLQ-C30量表中,信迪利单抗组和安慰剂组的TTD无显著统计学差异,在恶心和呕吐表现较好的患者中观察到OS的显著改善(中位OS:16.6个月 vs 13.1个月,HR:0.79,95% CI:0.65~0.97, P =0.0257)。对于QLQ-OES18量表,吞咽困难(中位OS:17.2个月 vs 13.3个月,HR:0.77,95% CI:0.63~0.94, P =0.0096)、吞咽唾液困难(中位OS:16.5个月 vs 12.8个月,HR:0.75,95% CI:0.57~0.97, P =0.0296)、吞咽时窒息(中位OS:16.9个月 vs 13.6个月,HR:0.80,95% CI:0.66~0.98, P =0.0304)各组的OS均存在显著差异。对于QLQ-C30量表,在身体机能变化较好(中位OS:16.9个月 vs 13.4个月,HR:0.80,95% CI:0.66~0.97, P =0.0241)和经济困难(中位OS:16.5个月 vs 12.6个月,HR:0.78,95% CI:0.62~0.99, P =0.0402)的患者中观察到OS的显著改善。对于QLQ-OES18量表,吞咽困难(中位OS:16.9个月 vs 12.1个月,HR:0.68,95% CI:0.55~0.83, P =0.0002)和说话困难(中位OS:16.3个月 vs 11.3个月,HR:0.72,95% CI:0.52~0.99, P =0.0409)的患者观察到OS的显著改善。
综上,与单独化疗相比,信迪利单抗联合化疗的患者在多个HRQoL量表上存在统计学显著差异,延迟恶化也有所改善。结合信迪利单抗联合化疗观察到的OS获益和安全性,研究结果支持该联合方案用于晚期ESCC患者的一线治疗。
医谷回声
……
1-
5月13日, Nature Medicine :阐述了情绪困扰(ED)与免疫检查点抑制剂反应的关系,指出恶性肿瘤治疗过程中针对情绪问题进行治疗的重要性 [4]。
此项前瞻性观察性研究的主要终点是研究者评估的PFS。次要终点是ORR、OS和QoL。探索性结果是治疗期间ED的动态变化,以及ED与生存结果之间潜在相关性的外周血ED生物标志物。研究最终纳入227例NSCLC患者进行分析。大多数患者为男性(92.5%),诊断为Ⅳ期NSCLC(58.1%),PS评分为1(81.1%)。大多数患者PD-L1阳性表达(71.8%),正在接受ICI联合治疗(94.7%),无脑/肝转移(86.3%),无高血压和糖尿病合并症(66.5%),体重指数低于24 kg/m 2(67.0%),中性粒细胞与淋巴细胞比值低于5(78.0%)。从病理诊断到ED评估的中位持续时间为16天(IQR:9~25天)。在基线评估中,发现48.9%的患者(111/227)正在经历ED,其中包括62例轻度ED患者(55.9%)和49例(44.1%)中度至重度ED患者。
数据截止时间为2023年11月30日。中位随访时间为16.0个月(95% CI:14.0~18.0),共观察到137例PFS事件。总人群的中位PFS为9.2个月(95% CI:7.0~11.4)。ED组的中位PFS为7.9个月(95% CI:6.2~9.7),无ED组的中位PFS为15.5个月(95% CI:7.8~23.2)。ED组的中位PFS显著短于无ED组(HR:1.73;95% CI:1.23~2.43; P =0.002)。此外,ED和PFS之间的这种一致的负相关在各个亚组中都很明显。在多变量Cox回归分析中,ED(HR:1.63;95% CI:1.15~2.31; P =0.006)和Ⅳ期疾病(HR:1.72;95% CI:1.13~2.63; P =0.012)成为PFS较差的独立预测因子。相反,PD-L1表达≥50%(HR:0.42;95% CI:0.24~0.72; P =0.002)被确定为PFS的有利预测因子。更进一步分析显示,轻度ED组和中度至重度ED组的中位PFS分别为8.8个月(95% CI:7.4~10.2)和7.1个月(95% CI:4.7~9.5)。相比于无ED患者,ED组患者疾病进展风险明显增加。此外,ED组患者的ORR及OS也更短。
QoL方面,ED组的整体健康得分较低,在身体功能、角色功能、情绪功能、认知功能和社会功能等各个功能领域得分较低。此外,ED组报告了更多的疲劳、疼痛、呼吸困难、失眠、食欲不振和便秘的症状,以及经历经济困难,除了恶心、呕吐和腹泻。外周血生物标志物检测也发现ED组血清皮质醇水平较高,而高皮质醇也会导致中位PFS较短、ORR趋势较低并增加患者的OS事件风险。
综上,研究确定了ED与ICIs在晚期NSCLC患者中的疗效降低之间的关联。此外,这项研究提供了关于ED与接受ICI的NSCLC癌症患者的生存结果相关的真实世界临床见解。同时,研究的发现也为其他癌症类型患者的心理治疗方面提供了依据。
2-
5月19日, International Journal of Surgery :浙江省肿瘤医院程向东教授、俞鹏飞教授团队回顾性评估了转化治疗中化学联合免疫治疗对 胃癌 伴腹膜转移患者的疗效,并建立了评估临床获益的预测模型 [5]。
研究共评估55例在转化治疗中接受化学免疫疗法的胃癌伴腹膜转移的患者。
化疗联合免疫治疗在胃癌伴腹膜转移患者中实现了41.8%的ORR和72.4%的R0切除率。接受转化手术的患者比未接受手术的患者表现出更好的OS(中位OS:未达到 vs 7.82个月, P <0.0001)。与无反应者相比,化学免疫治疗应答者表现出更高的ERBB2和ERBB3突变频率、CTLA4和HLA-DQB1表达以及CD8 + T细胞浸润,但CDH1突变和初始CD4 + T细胞浸润较低。研究团队建立整合CDH1和ERBB3突变、HLA-DQB1表达和初始CD4 + T细胞浸润的预测模型(AUC=0.918),并使用独立的外部队列(AUC=0.785)进一步测试。
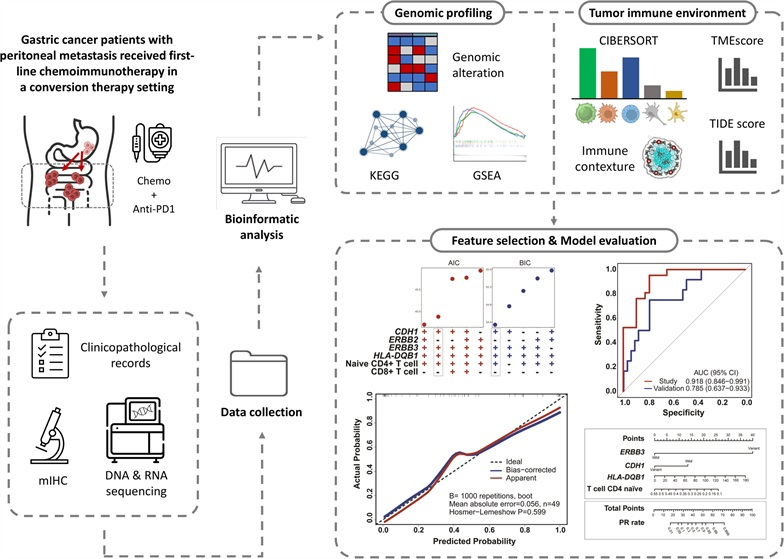
本探索性研究全面评估了临床病理学、基因组学和免疫学特征,并建立了一种新的预测模型,为选择胃癌伴腹膜转移患者进行化学免疫治疗相关转化治疗提供了合理依据。
3-
5月20日, Clinical And Translational Medicine :中山大学研究团队揭示 肝癌 治疗新策略 [11]。
2019年,研究人员通过收集31个公开的肝癌细胞系和生成50个中国患者来源模型建立了肝癌模型库(LIMORE)。此外,该团队在所有81个细胞模型中使用了90种抗癌药物,对药物进行了多样化的响应分析。基于该数据库,研究人员对筛选出的针对具有TERT启动子突变的HCC细胞的潜在药物进行了以下分析。根据细胞对90种临床药物的活性分析,将细胞分为三个簇:耐药细胞(n=16)、未分类细胞(n=46)和敏感细胞(n=19)。随后,研究人员选择了这24个细胞进行进一步分析。将TERT WT与TERT Mut的IC50比进行排名,结果PLK1抑制剂BI2536名列第一。然后,研究人员扩大了样本,并确认TERT Mut细胞对BI2536的敏感性高于TERT WT细胞。
为进一步验证这一结果,研究人员在13个具有不同组织学和遗传背景的细胞系中进行了BI2536治疗后的细胞存活性检测,其中包括两个正常肝细胞(THLE2和THLE3)、五个具有野生型TERT(MHCC-97H、Huh1、SK-HEP-1、SNU761和PLC/PRC/5)的HCC细胞以及六个具有突变型TERT(HLF、SNU878、SNU886、SNU739、HLE、Huh7)。此外,BI2536和NMS-P937显著抑制了携带G228A突变的Huh7异种移植瘤的生长,但对携带野生型TERT启动子的SK-HEP-1异种移植瘤的生长影响不大。结果表明,PLK1抑制剂可通过Smad3途径特异性抑制TERT突变HCC细胞的生长,从而为治疗携带TERT启动子突变的HCC患者提供了一种新的治疗策略。
高峰科讯
……
1-
5月8日, Cell Reports Medicine :中国科学院肖意传研究员团队联合江苏省肿瘤医院戴东方副主任医师团队和复旦大学附属肿瘤医院陈小祥主任医师和黄明主副主任医师团队合作揭示放化疗诱导肿瘤微环境中T细胞衰老的机制 [6]。
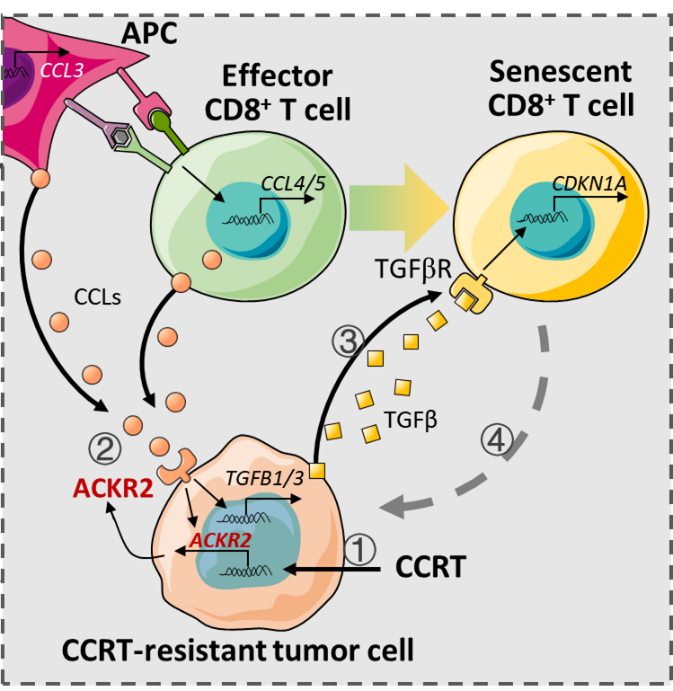
研究人员通过单细胞测序技术在 宫颈癌同步放化疗(CCRT)治疗后发现CCRT治疗可诱导宫颈癌TME中CD8 +T细胞衰老。为探究CCRT诱导TME中CD8 +T细胞衰老的机制,研究人员进一步分析了TME中的髓系免疫细胞和肿瘤细胞,发现一群在CCRT治疗后数量并没有大幅减少的肿瘤细胞亚群通过高表达ACKR2与TME中的CD8 +T细胞产生极强的相互作用。
通过过表达和敲低ACKR2的宫颈癌肿瘤细胞与CD8 + T细胞共培养,或通过建立相应的宫颈癌小鼠肿瘤模型分析发现,肿瘤细胞高表达ACKR2会促进共培养体系中或小鼠肿瘤TME中CD8 + T细胞的衰老,而敲低ACKR2则会抑制其衰老的发生。
此外,研究人员还发现ACKR2过表达后会促进宫颈癌肿瘤细胞高表达TGFβ,如果利用TGFβ的抑制剂或阻断抗体处理后,则会部分阻止放化疗处理诱导的CD8 +T细胞衰老,说明TGFβ信号介导了CCRT诱导的CD8 +T细胞衰老。因此,ACKR2和CD8 +T细胞衰老可以作为潜在的宫颈癌CCRT治疗后复发与否的早期诊断标志物。
2-
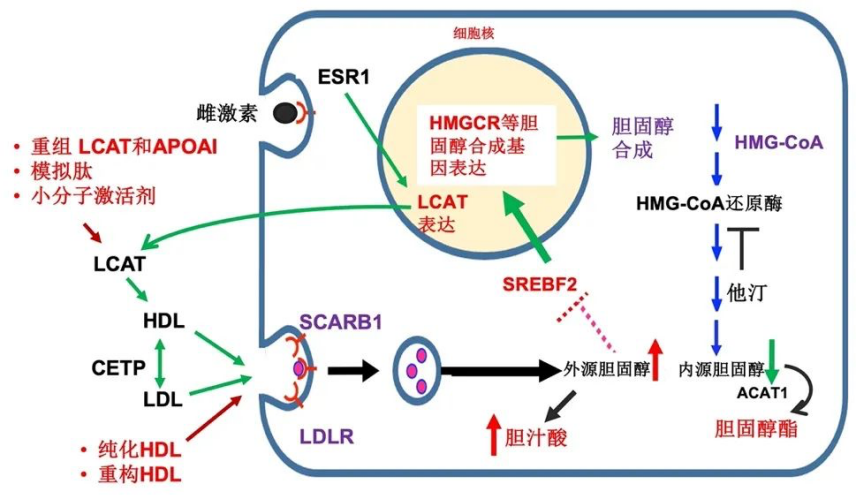
5月8日, Cancer Research :武汉大学生命科学学院黄赞教授团队揭示雌激素调控肝癌发生性别差异的代谢新机制 [7]。
既往研究证实雌激素可通过抑制炎症和乙肝病毒阻止肝细胞癌发展,但雌激素调控抑制HCC的机制尚未得到充分阐释。
研究人员通过对小鼠和人类肝癌的转录组分析发现卵磷脂-胆固醇脂酰转移酶(LCAT)是受雌激素调节时上调最多的基因。LCAT通过LDLR和SCARB1途径促进高密度脂蛋白胆固醇(HDL-C)的产生和摄取,HDL-C可抑制胆固醇合成关键调控因子SREBP2的成熟,最终抑制胆固醇的合成并减缓HCC细胞的增殖。
此外,研究人员利用动物模型证实,LCAT缺乏会导致HCC携带雌性小鼠雌激素缺乏,促进HCC肿瘤生长,而LCAT的过表达可消除这种促进作用,延缓裸鼠皮下肿瘤的发展。本研究揭示雌激素可通过上调LCAT来维持胆固醇稳态,并抑制HCC的发生。LCAT和HDL-C是潜在的HCC预后生物标志物,能为改善HCC的预防和治疗提供新思路。
3-
5月13日, Cell Reports Medicine :南方医科大学研究团队发现脑转移肿瘤治疗新策略 [8]。
为评估靶向抑制HSP47对BrM的影响,研究人员使用Col003进行研究,它能竞争性地结合HSP47的胶原结合位点。研究人员在体外验证Col003对4T1-BMT5和LLC1-BMT5细胞的处理可显著降低培养基中COL1的水平,呈剂量依赖性,半数抑制浓度分别为3.96和4.68微摩尔。Col003的分子量为247,但其穿透血脑屏障(BBB)的能力尚未评估。为此,研究人员将Col003(20毫克/公斤)静脉注射给小鼠,并在不同时间点量化脑脊液(CSF)中Col003的浓度。Col003可在注射后30分钟内迅速进入CSF,在注射后2小时达到约5微克/毫升的峰值,并在至少12小时的给药后保持在1微克/毫升的水平。这一结果表明,Col003具有较好的BBB渗透性和体内耐受性。
此外Col003还显著增加了脑转移病灶中增殖、活化和杀伤性CD8 +T细胞的数量,同时抑制了CD4 +Treg细胞的数量。在连续的小鼠脑组织中,研究人员证实Col003抑制了COL1的沉积,并促进了CD8 +T细胞的浸润。这些结果共同表明,HSP47是M2小胶质细胞极化和免疫抑制的关键决定因素,阻断HSP47-胶原轴是对抗脑转移肿瘤的一种有前途的治疗策略。
4-
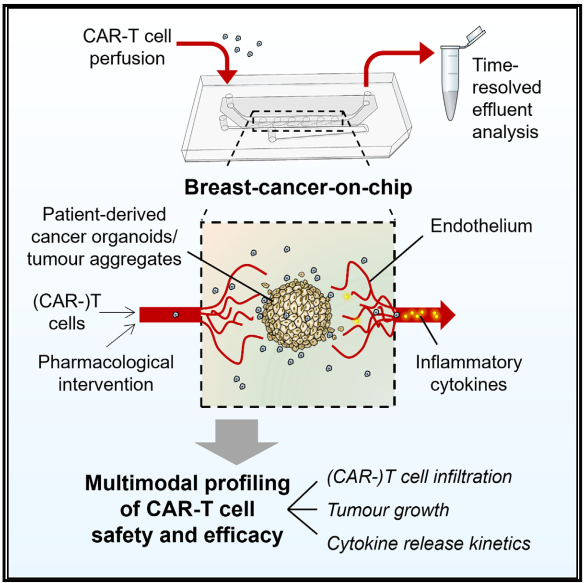
5月15日, Cell Stem Cell :新型 乳腺癌 芯片模型用于监测CAR-T治疗效果和安全性 [9]。
为了重现CAR-T细胞的输注、招募和渗透到实体肿瘤中的过程,监测针对特定患者治疗的安全性和有效性,研究人员开发了一种集成内皮屏障的乳腺癌芯片模型,该模型允许灌注的免疫细胞穿越内皮屏障、浸润肿瘤,并在灌注培养期间(最长可达8天)监测细胞因子的释放。
CAR-T细胞疗法常常伴随着外周血中促炎细胞因子水平的增加。研究人员发现,与对照组T细胞相比,多种细胞因子在CAR-T细胞组水平都较高,这些细胞因子的分泌通常会导致细胞因子释放综合征的发生。该模型可通过控制CAR-T细胞衍生的细胞因子的分泌来研究适当干预策略的可行性,同时不会减弱CAR-T细胞的杀伤效果。
芯片模型的模块化架构为研究其他细胞类型在肿瘤微环境中的作用提供了可能,在从实验室到临床的转化应用中具有广泛潜力,加速CAR-T细胞产品的临床前开发。
5-
5月20日, Advanced Science :武汉大学中南医院研究团队揭示 结直肠癌 最新治疗选择 [10]。
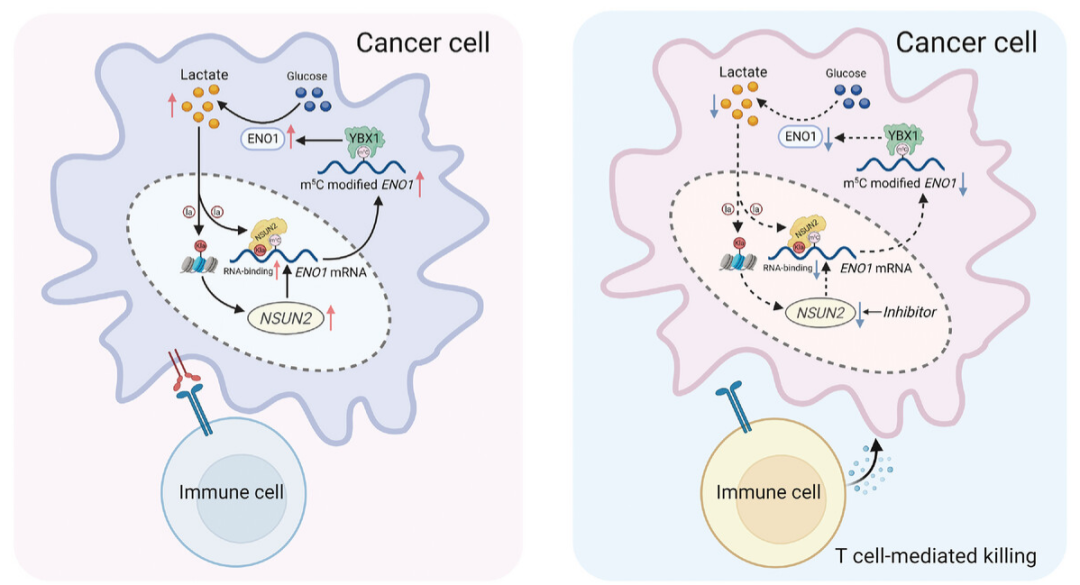
CRC是癌症相关死亡的第二大原因,转移性CRC病例的5年生存率仅为13.1%。深入了解结直肠癌的进化和转移机制对于开发精确有效的治疗方法至关重要。研究证实m 5 C修饰可导致各种癌症的发生,但m 5 C的修饰是否可能促进CRC的发展有待全面阐明。
本研究确定m 5 C甲基转移酶NSUN2在CRC中表现出显著升高的表达并发挥致癌功能。机制上,NSUN2和YBX1被确定为ENO1的“写入者”和“读取者”,最终以m 5 C依赖的方式重编程葡萄糖代谢和增加乳酸的产生。来自CRC细胞的乳酸积累反过来通过组蛋白H3K18乳酰化(H3K18la)激活NSUN2的转录,并诱导NSUN2在Lys356残基(K356)的乳酰化,这对于捕获靶RNA至关重要。研究人员对NSUN2/YBX1/m 5 C-ENO1信号转导轴的研究阐释了代谢重编程和表观遗传重塑之间的联系,这揭示了NSUN2抑制剂与CRC免疫疗法联合治疗的潜力。
刊后语
大风泱泱,大潮滂滂;大道如砥,医者无疆。
积跬步以至千里,每一期周刊都是恶性肿瘤学科发展的剪影;积小流以成江海,一年周刊浓缩肿瘤领域各科前沿进展的精华!关注CACA周刊,带你领略恶性肿瘤学科发展的四季花开。
CACA周刊,我们下周不见不散!
编辑 | 李瑞源 端午 YANG
排版 | 晓晓
审核 | 李瑞源
链接:http://www.lewenyixue.com/2024/08/05/%E3%80%90CACA%E5%91%A8%E5%88%8A%E3%80%9171%E6%9C%9F%20%E8%82%BF%E7%98%A4%E5%85%8D%E7%96%AB%E6%B2%BB%E7%96%97%E8%B6%85%E8%BF%9B/







赶快来坐沙发