Science丨人源TIP60复合物的组装及其招募机制
染色质的共价和非共价修饰是两种主要的染色质修饰方式,他们通常会改变染色质的组成和结构,从而在基因表达的调控过程中发挥着至关重要的作用。人类的TIP60复合物是酵母NuA4和SWR1复合物的融合体,作为一个具备染色质的共价和非共价修饰活性的复合物,它可以进行组蛋白乙酰化和H2A.Z/H2B组蛋白交换两个过程。研究发现TIP60的突变与人类的多种疾病相关,其中包括癌症和阿尔茨海默病,因此它也被多个研究机构作为可能的药物靶点。然而,目前我们对其组装和双重功能机制的理解还很不足,在很大程度上限制我们对这个激活基因表达的“心脏”的认识。另外,多项研究表明 人源TIP60可以通过其最大的亚基TRRAP (与SAGA复合物共享) 与转录因子相互作用,而被招募到特定位点,从而建立从activitor到co-activitor的联系。然而TRRAP如何在这两个大型复合物之间分配以及它在TIP60中的具体角色尚待探索。
图1. 人源TIP60的复合结构及其调控基因表达的模式图
近日,近日,来自美国加州大学伯克利分校/霍华德休斯医学研究院的 Eva Nogales 课题组联合加拿大Laval University的 Jacques Côté 课题组在 Science 上发表题为 Structural insights into the human NuA4/TIP60 acetyltransferase and chromatin remodeling complex 的文章, 通过结构生物学,交联质谱和基因组学分析等手段阐述了人源TIP60复合物的组装及其在体内特异的调控基因表达过程 。
首先,研究人员利用CRISPR技术构建了能够进行TIP60复合物Flag亲和纯化的K562细胞系。通过大量的探索和尝试,他们最终纯化出了高质量、包含至少19个亚基、分子量为1.85兆道尔顿的人内源性TIP60复合物。在此基础上,研究人员进一步阐述了该复合物的双重酶活性及其偶联关系。具体而言,他们发现TIP60复合物的组蛋白乙酰化活性能够在很大程度上提升组蛋白H2A.Z/H2B的交换活性,这与酵母中同源蛋白的研究相互验证。相反,TIP60复合物的组蛋白H2A.Z/H2B的交换活性并不能促进组蛋白乙酰化活性。
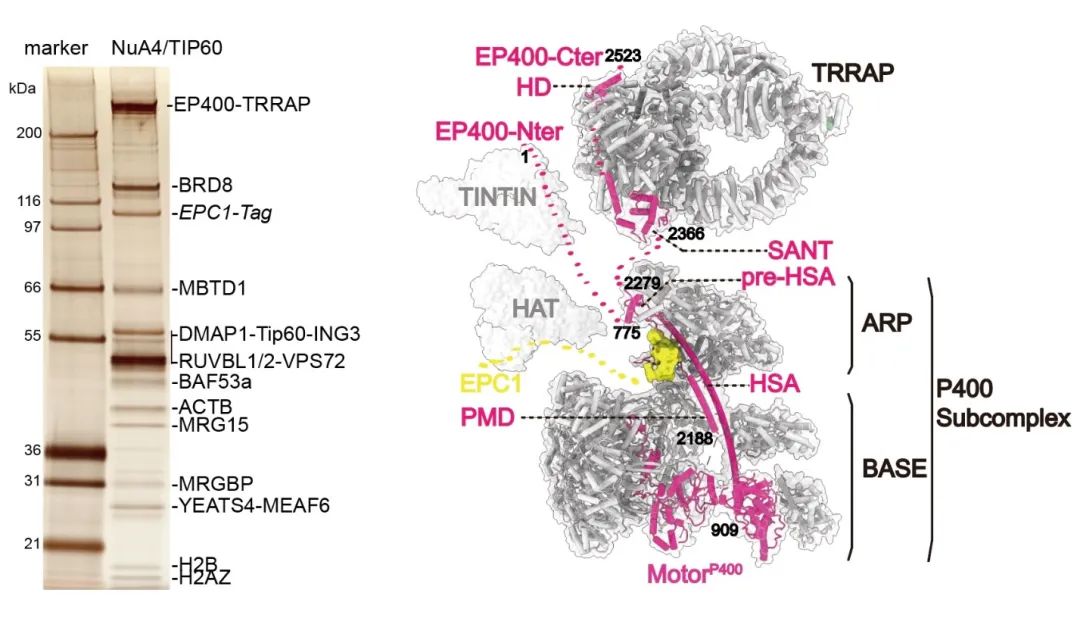
在进一步的冷冻电镜研究中,研究人员解析了包含10个不同蛋白共15条多肽链组成的复合物结构。然而,剩余至少一半分子量的组分由于结构上的摆动性无法确定其原子模型,其中最具代表性的是其最大亚基TRRAP的空间位置无法测定。在此基础上,研究人员构建了新的细胞系,通过EP400蛋白的C末端成功将内源性的TRRAP模块从体内分离出来,并解析出TRRAP模块的结构。综合交联质谱和结构生物学获得的信息,研究人员提出了人源TIP60复合物的三维结构模型。该复合物总共包括五个模块,它们分别是TRRAP模块、ARP模块、BASE模块、HAT模块和TINTIN模块。其中,ARP模块位于整个结构的中心,作为交通枢纽与其余模块之间发生直接或间接的联系。EP400蛋白在TIP60复合物中起支架作用,直接与所有功能模块相互作用。
深入的结构生物学分析表明,ARP模块通过其带有负电的口袋与HAT模块的EPC1亚基发生强烈的相互作用,从而将HAT模块锚定在ARP模块上。更有趣的是,研究人员发现,与其对应的SRCAP和SWR1重塑复合物相比,ARP模块呈现出一种完全不同的位置。通过交联质谱测定了核小体与TIP60中负责H2A.Z/H2B交换的亚复合物的互作模式,发现ARP模块在结合核小体后可能发生构象变化,这种变化与观察到的SRCAP复合物相似但可能不同。研究人员还发现,TIP60复合物的TRRAP模块通过与EP400亚基的SANT和HD结构域分别发生极性和非极性的相互作用,使得TRRAP模块能够与剩余组分紧密相互作用。这些特定相互作用的位置对于形成SAGA复合物也至关重要,因此阻止了TIP60复合物和SAGA复合物通过TRRAP形成更高形式的混合复合物。体内实验发现,删除EP400的SANT和HD结构域会导致TRRAP模块的脱离。最终,研究人员通过一系列基因组学分析,详细研究了TRRAP模块在体内的作用。TRRAP模块可以将TIP60复合物定位在基因组的正确位置,从而使TIP60复合物能够对该位置的染色质进行乙酰化修饰和H2A.Z/H2B的交换,进而激活对应位置的基因表达。当删除TRRAP模块后,TIP60将在染色质上重新定位,在新的染色质位置进行乙酰化修饰和H2A.Z/H2B的交换,从而影响基因的表达模式。
该研究首次解析了人源TIP60复合物的组织结构,阐明了TIP60复合物如何协调H2A.Z/H2B交换和组蛋白乙酰化这两种重要的染色质修饰方式,并详细解答了TRRAP模块如何帮助TIP60复合物在基因组上定位这一重要的生物学问题。
加州大学伯克利分校/霍华德休斯医学研究院博士后研究员 杨振林 ,加拿大Laval University的博士研究生 Amel Mameri 为该论文的第一 (共同) 作者。加拿大Laval University的 Jacques Côté 教授和加州大学伯克利分校的 Eva Nogales 教授是该论文的共同通讯作者。美国Institute for Systems Biology的Jie Luo博士和Jeff A. Ranish教授在该论文的交联质谱工作中提供了大量帮助。加州大学伯克利分校的Claudia Cattoglio博士对该论文的基因组数据处理做出了重要贡献。
http://doi.org/10.1126/science.adl5816
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/08/03/Science%E4%B8%A8%E4%BA%BA%E6%BA%90TIP60%E5%A4%8D%E5%90%88%E7%89%A9%E7%9A%84%E7%BB%84/
THE END






赶快来坐沙发