回顾与盘点:到目前为止,全球共有几个免疫检查点抑制剂获批宫颈癌适应症?
我们在不断学习新进展、新内容的同时,也要经常回顾已有的内容;不能学了新知识,却忘了旧知识。
到目前为止,全球范围内共有6个免疫检查点抑制剂获批晚期宫颈癌二线治疗。
按照获批的时间先后,这6个免疫检查点抑制剂分别如下:
2018年6月,FDA批准 帕博利珠单抗 (PD-1单抗) 用于化疗期间或化疗后疾病进展且 PD-L1表达阳性(CPS ≥ 1) 的复发或转移性宫颈癌 (国内暂未获批)。该适应症的批准是基于Keynote-158试验,目前该试验的最新数据是2021年SGO年会上公布的更新数据。

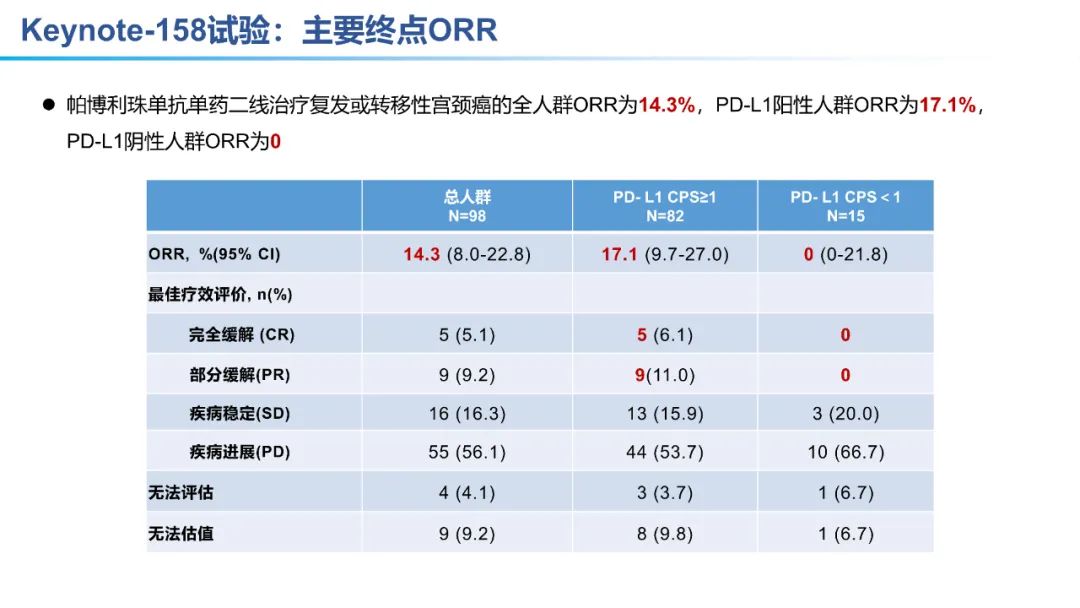
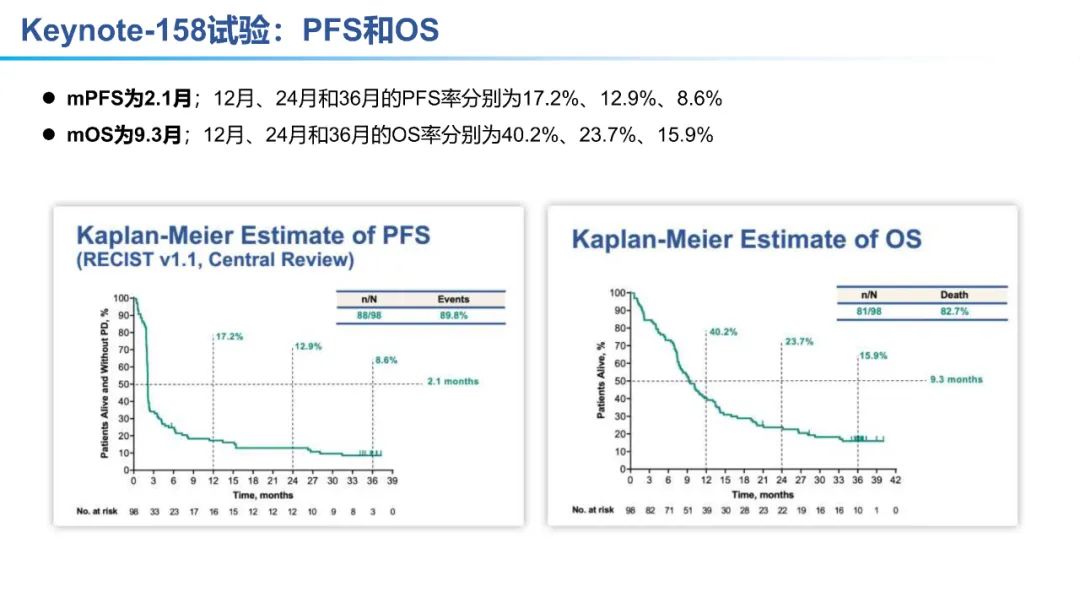
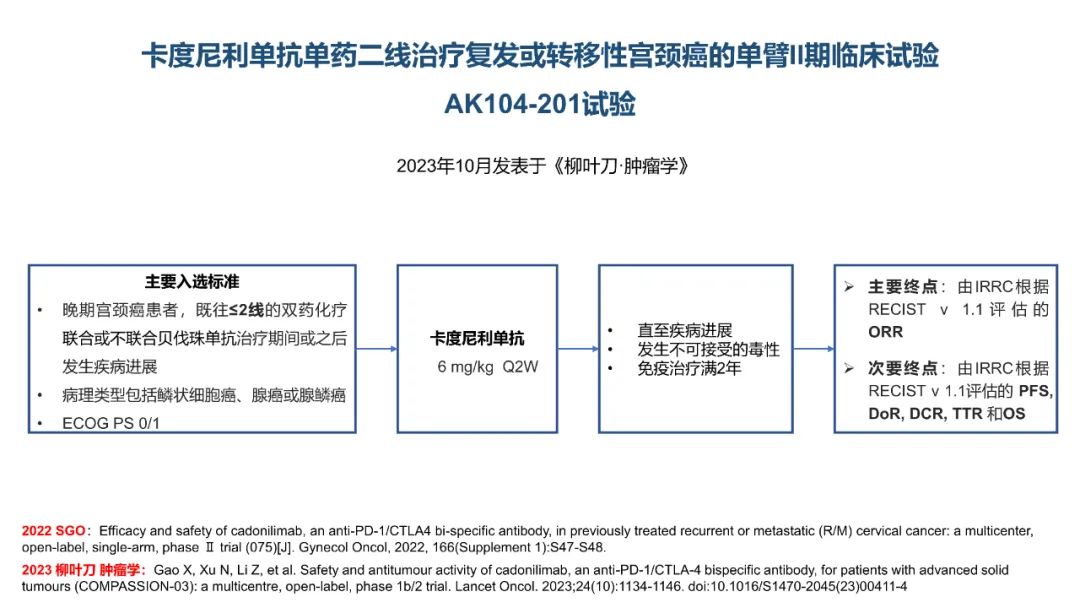
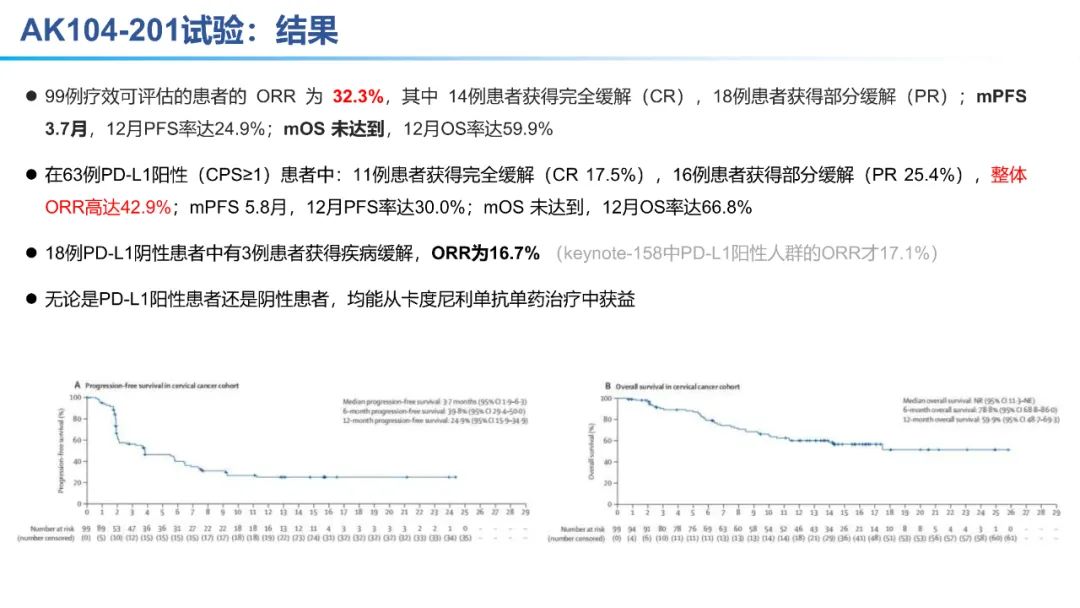
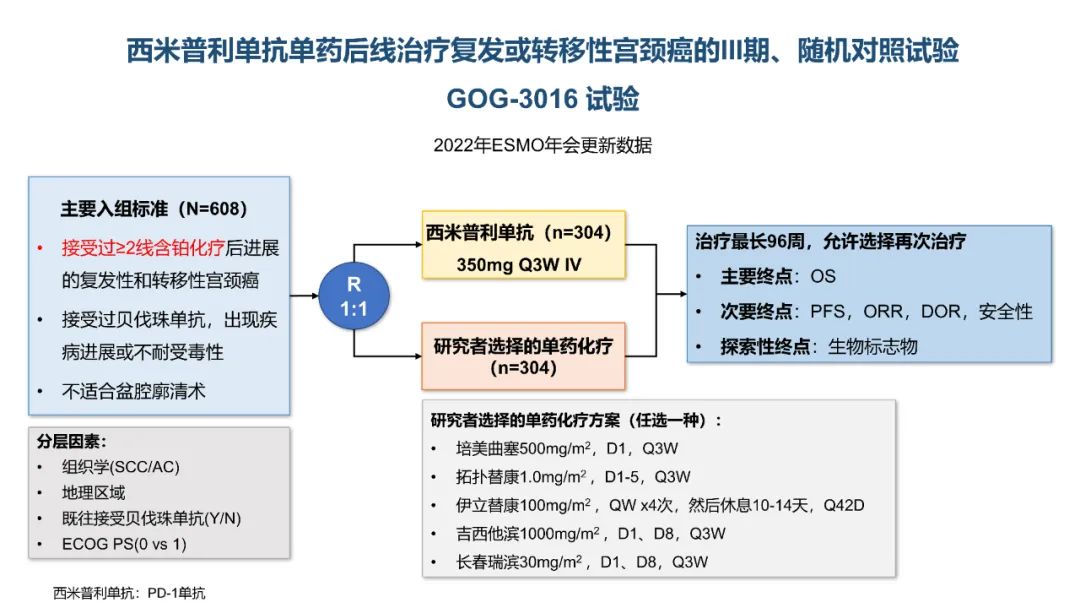
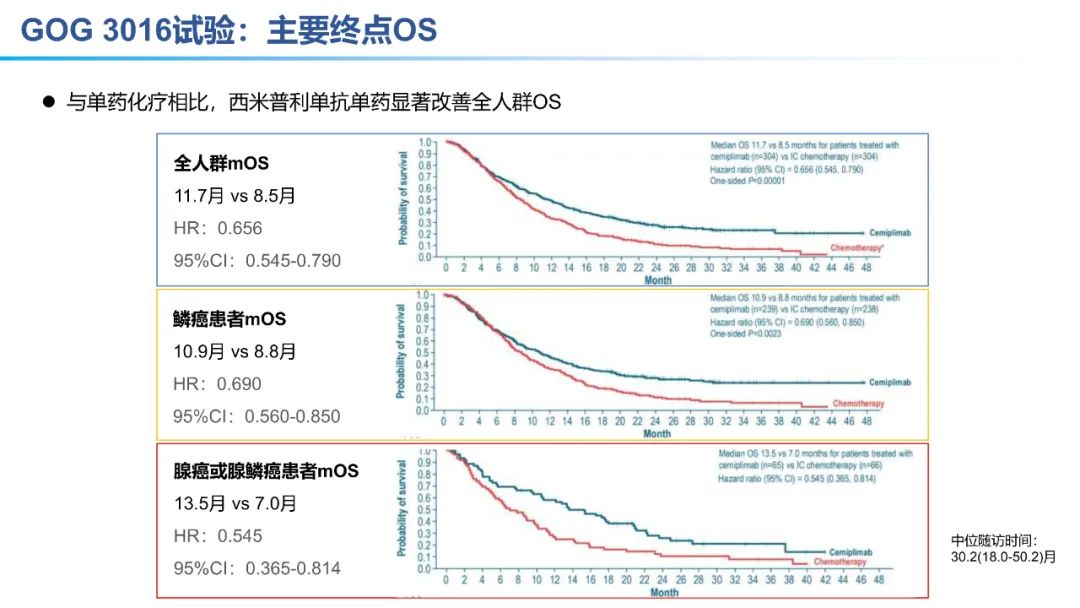
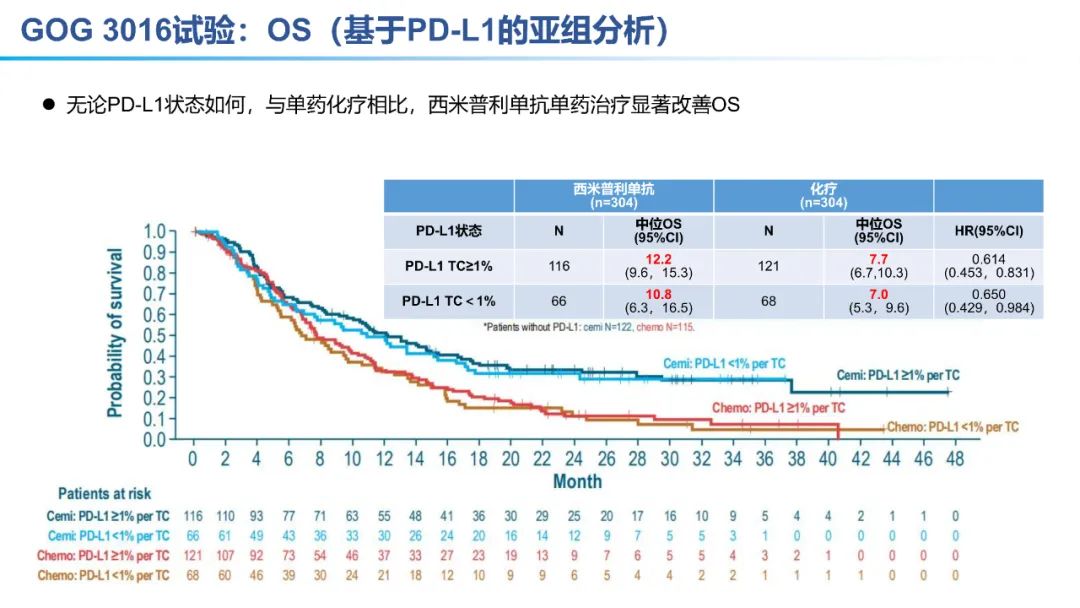
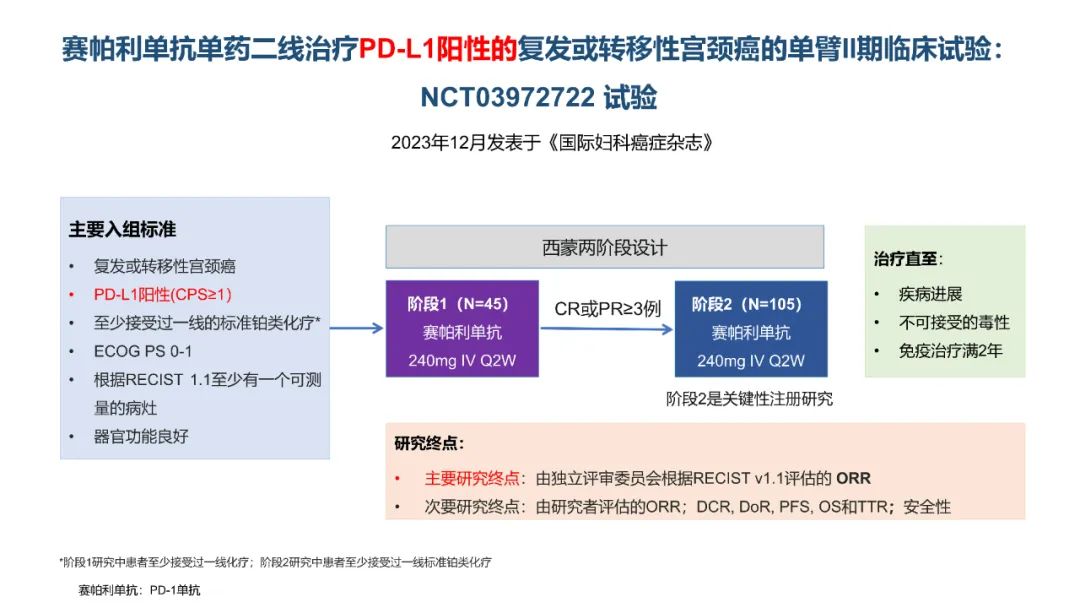
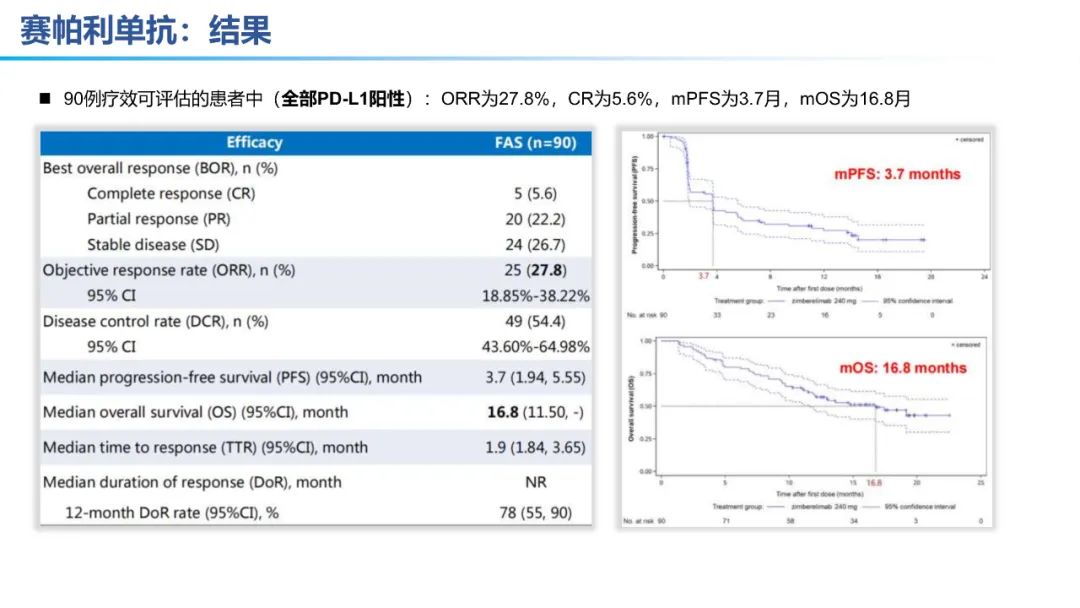


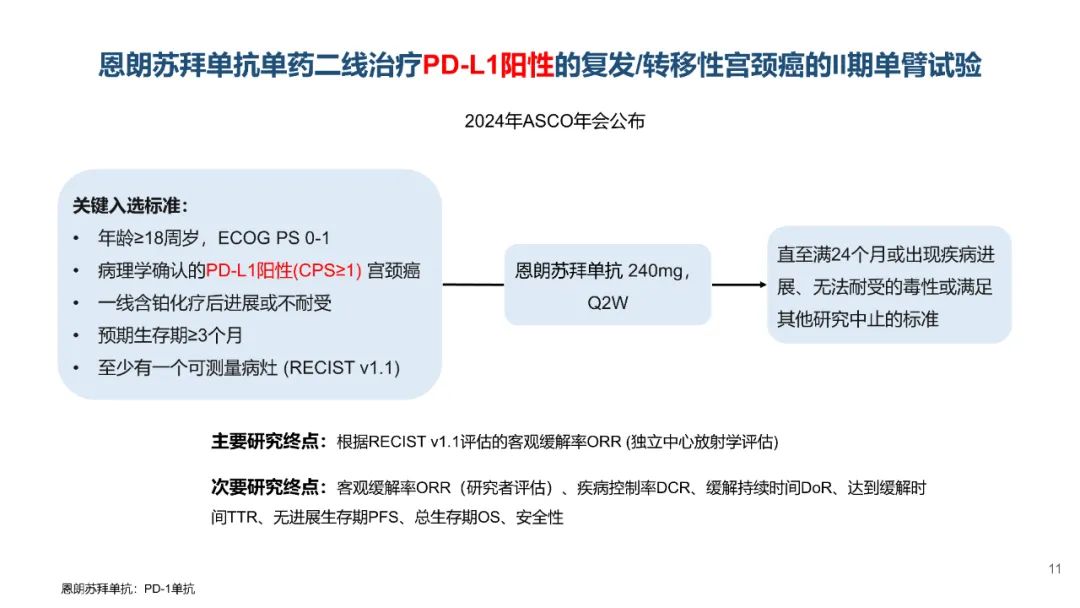
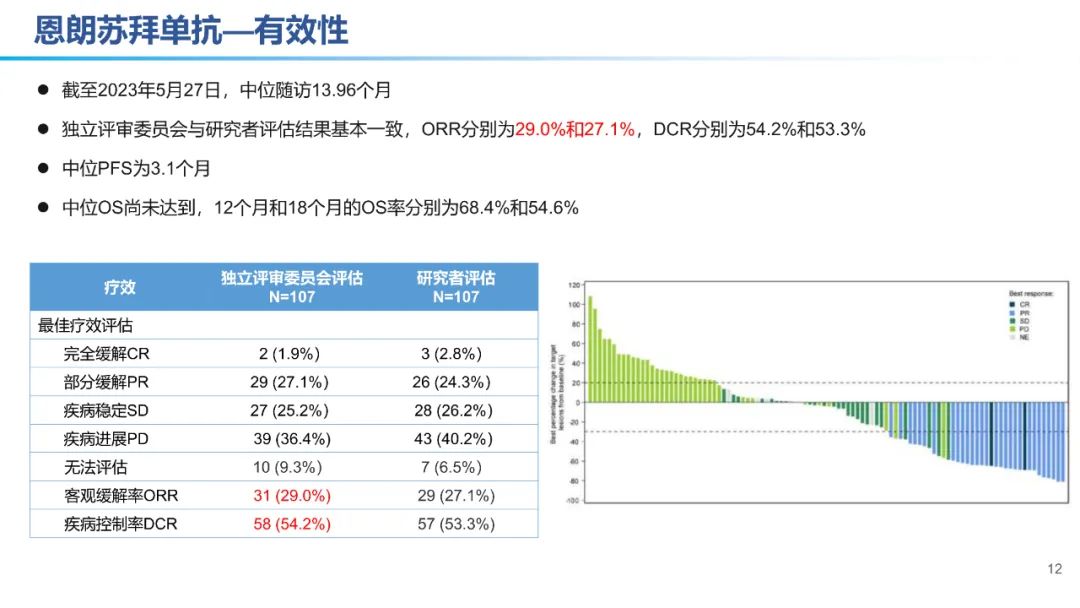

从数据的大小比较来看,卡度尼利单抗一药双靶,可以为晚期宫颈癌全人群患者带来明显更优的生存获益。
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/08/01/%E5%9B%9E%E9%A1%BE%E4%B8%8E%E7%9B%98%E7%82%B9%EF%BC%9A%E5%88%B0%E7%9B%AE%E5%89%8D%E4%B8%BA%E6%AD%A2%EF%BC%8C%E5%85%A8%E7%90%83%E5%85%B1%E6%9C%89%E5%87%A0%E4%B8%AA%E5%85%8D%E7%96%AB/
链接:http://www.lewenyixue.com/2024/08/01/%E5%9B%9E%E9%A1%BE%E4%B8%8E%E7%9B%98%E7%82%B9%EF%BC%9A%E5%88%B0%E7%9B%AE%E5%89%8D%E4%B8%BA%E6%AD%A2%EF%BC%8C%E5%85%A8%E7%90%83%E5%85%B1%E6%9C%89%E5%87%A0%E4%B8%AA%E5%85%8D%E7%96%AB/
THE END