大剂量维生素C在肿瘤患者应用的安全性观察
目的:观察大剂量维生素C静脉滴注治疗晚期恶性肿瘤的安全性,为临床合理用药提供参考。
方法:收集航空总医院2016年4月至2017年6月应用大剂量维生素C治疗晚期恶性肿瘤的患者共计21例,分别记录这21例肿瘤患者在应用大剂量维生素C治疗前、治疗后可能存在的恶心、食欲下降、腹胀、腹泻、腹痛、头晕等症状,以及前后两组的血糖、电解质(血Na+、K+及Cl-)和肝肾功能(谷丙转氨酶、谷草转氨酶、总胆红素、尿素、肌酐和尿酸)等参数,然后以配对检验方法比较这些患者在大剂量维生素C治疗后上述临床症状和血液生物化学参数有无明确的统计学差异。
结果:在应用大剂量维生素C静脉滴注治疗恶性肿瘤的过程中,患者血糖、电解质以及肝肾功能等未见明显变化,1例患者诉食欲下降,1例患者诉恶心、腹胀加重,1例患者出现下肢水肿,但是再次使用维生素C时未见类似症状及表现,未见腹泻、腹痛、头晕等症状。
结论:应用大剂量维生素C治疗晚期恶性肿瘤患者尚未发现明确的不良反应,安全性良好。
关键词:大剂量维生素C;肿瘤;不良反应;安全性
正 文
近30年来,众多研究表明,大剂量维生素C可以用于治疗肿瘤。大量动物实验及部分临床观察已经证明,大剂量维生素C可以显著改善肿瘤状况,延长生存期[1-4]。尽管如此,其安全性仍然是医务人员关心的问题,有报道称大剂量维生素C可以引起溶血及肾功能衰竭[5]。中国医科大学航空总医院普通外科从2016年4月开始应用大剂量维生素C治疗进展期恶性肿瘤,发现大剂量维生素C安全性良好,报告如下。
1 资料与方法
1.1 一般资料
纳入研究的21例患者中,10例为结直肠癌、4例为胃癌,2例为胰腺癌,其余5例为肝癌、胆管癌、乳腺癌、恶性纤维组织细胞瘤和血管内皮瘤,各1例。其中男性11人,女性10人;所有均为Ⅳ期伴远处转移患者。年龄最大为81岁,最小为31岁,平均年龄61.5岁。
1.2 方法
1.2.1 处理方法
所有患者以每公斤体重1g维生素C计算用量,维生素C溶入500ml 5%葡萄糖溶液或500ml注射用水经外周静脉或中心静脉缓慢滴注,3~4次/周,7~10次/周期。
1.2.2 观察指标
一周期治疗前、治疗后分别检测并统计患者血糖、部分电解质(血Na+、K+及Cl-)以及肝脏功能包括谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase, AST)、总胆红素(total bilirubin,TBIL)和肾脏功能包括尿素(urea,UR)、肌酐(creatinine,CR)、尿酸(uric acid,UA)等关键指标变化,以及用药前后恶心、呕吐、食欲变化、腹胀、腹泻、腹痛、头晕等不良反应的情况。
1.2.3 统计学方法
应用SPSS 20.0软件进行统计学分析,获得治疗前、治疗后2组配对数据后,对计量资料以均数±标准差表示,采用配对资料的t检验;计数资料以例数表示。显著性水平取P≤0.05。
2 结果
2.1 血糖
治疗前患者平均血糖为(5.49±1.41)mmol/L,治疗后为(5.48±1.10)mmol/L,对比治疗前后两组血糖整体未见明显变化(配对t检验,P=0.17),认为治疗前与治疗后血糖变化无统计学意义。
2.2 电解质(血Na+、K+及Cl-)
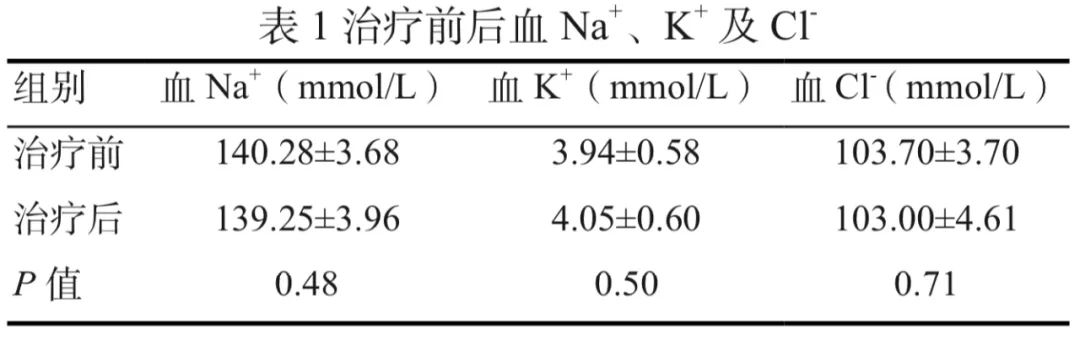
治疗前后患者血Na+、血K+和血Cl-的变化见表1,配对t检验结果显示,治疗前后3种电解质的变化均无统计学意义。
2.3 肝脏功能
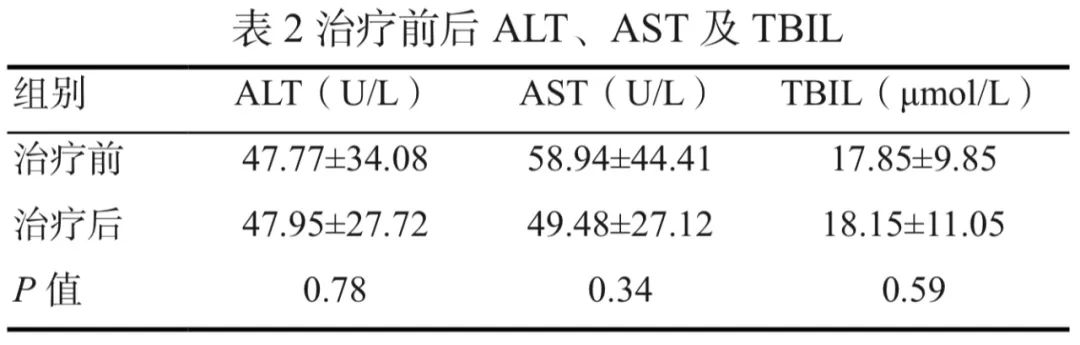
治疗前后患者肝脏功能关键指标ALT、AST和TBIL的变化见表2,配对t检验结果显示,治疗前后3种关键指标的变化均无统计学意义。
2.4 肾脏功能
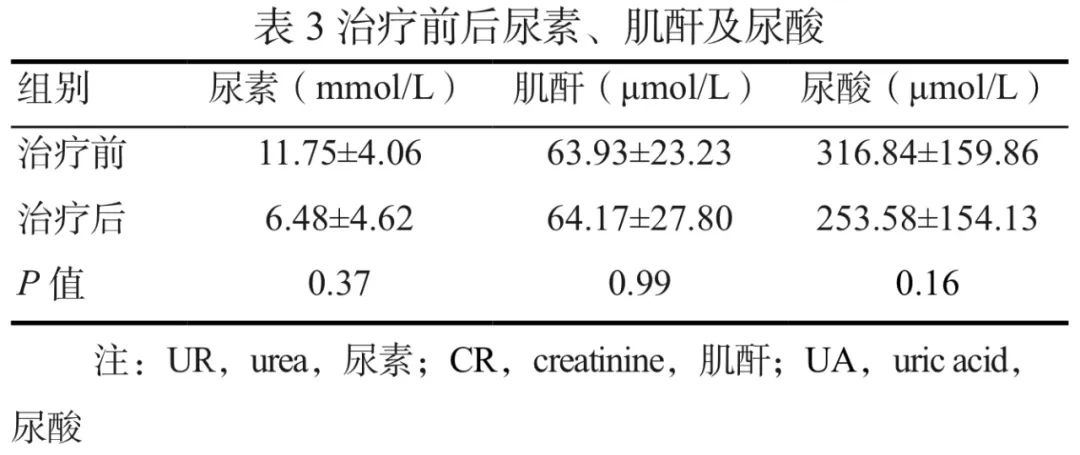
治疗前后患者肾脏功能关键指标UR、CR和UA的变化见表3,配对t检验结果显示,治疗前后3种关键指标的变化均无统计学意义。
2.5 症状
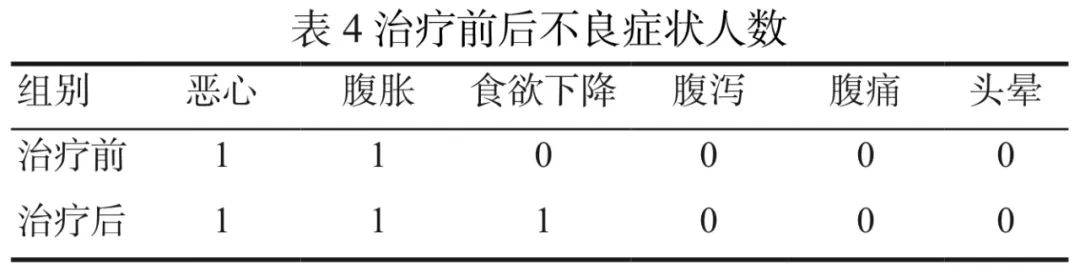
21例患者中,有1例在治疗前、后均存在恶心、腹胀,使用维生素C后症状加重;1例诉食欲下降;1例出现右下肢水肿,下肢超声检查未见异常,再次使用大剂量维生素C时,未见类似症状及表现。其余患者在治疗前及治疗后均无恶心、腹胀、腹泻、腹痛、头晕等不良反应,见表4。治疗前、后不良反应出现的情况无差异。
3 讨论
维生素C,也称为抗坏血酸或L-抗坏血酸,是一种水溶性维生素和强效抗氧化剂。发现于1912年,于1928年分离出来,并于1933年成为第一种化学生产的维生素[6]。
维生素C是人类和某些动物的必须营养素,是很多酶促反应的辅助因子,在人体许多基本功能中起到很重要的作用:①维生素C对结缔组织的发育和维持至关重要,它在骨形成、伤口愈合和维持健康牙龈中起重要作用[7];②它是一种抗氧化剂,可以保护身体免受自由基的伤害[8];③维生素C参与免疫防御系统,吞噬细胞产生自由基作为人体的抗感染防御系统的一部分,以及中和抗氧化剂,以防止对免疫细胞本身的损坏[9]。有研究已经表明,维生素C可以刺激小鼠腹腔巨噬细胞的吞噬反应[10]。在人体中,与单独使用维生素C相比,补充维生素C和E似乎更具免疫增强作用[11]。
维生素C的抗氧化和免疫防御功能可能对肿瘤患者有益,包括促使肿瘤消退和抑制肿瘤生长。流行病学研究表明,维生素C对非激素依赖性恶性肿瘤具有保护作用[11]。有越来越多的证据表明,维生素C对一些类型的肿瘤细胞具有选择性毒性,并有助氧化剂的作用[12,13]。其中一些研究表明,高剂量维生素C治疗可能对胰腺癌患者[14,15]和其他晚期癌症[16]具有临床益处,但迄今为止相关研究较少。此外,膳食维生素C补充剂的使用与改善乳腺癌患 者预后有关[17,18]。
但只有高浓度的维生素C对体外癌细胞有毒性作用[19,20]。这些浓度通常只能通过静脉内给药实现。静脉注射1.25g后,可达到血浆峰值水平1,000μmol/L,但由于限制吸收机制,口服给药不能超过100μmol/L[21]。最新数据显示,根据剂量和输注速度,静脉注射的血浆峰浓度可达14,000μmol/L,浓度超过2,000μmol/L可持续数小时[22]。
维生素C在人体内发挥抗肿瘤作用时所需要的浓度远超正常使用时的药物浓度,约为后者的几十倍到上百倍[23,24]。根据药物不良反应的临床表现与药理作用的关系,一般将不良反应分为A型和B型。其中A型指由于药物的药理作用增强而引起的不良反应,其程度的轻重与用药剂量有关,发生率较高,这也正是本次研究所调查的类型。B型不良反应与用药剂量没有关系,并且发生率较低,不在本研究讨论之中。
已经有研究表明,①高浓度的维生素C可以导致葡萄糖-6-磷酸脱氢酶(G6PD)水平不足,导致患者在使用静脉内维生素C治疗后出现溶血性贫血[25]。G6PD缺乏症检测是一种常见的实验室检查。使用大剂量维生素C前应该常规检查G6PD;②维生素C可酸化尿液,这可能会促进肾结石或药物沉淀在尿中[26];③其他的不良反应包括腹泻、草酸盐排泄增加,尿酸排泄增加,反跳性坏血病,过氧化物反应,铁超负荷,维生素B12和铜吸收减少,需氧量增加和腐蚀牙齿[27]。
为了观察分析大剂量维生素C静脉滴注治疗晚 期恶性肿瘤可能出现的不良反应,从而为临床合理用药提供参考。本研究,调查了我院21例应用大剂量维生素C治疗的患者,尚未发现大剂量维生素C对患者的血糖、肝脏功能、肾脏功能、电解质平衡、胃肠道功能等造成确切的不良影响。对于是否在长期应用后,或远时间内出现贫血、泌尿系结石等,还有待于进一步调查研究。OuJ等使用维生素C剂量达到1.5g/kg,也未见明显不良反应[28]。依目前本研究实践,尚未发现大剂量维生素C治疗后出现确切的不良反应,对于晚期肿瘤患者,大剂量维生素C治疗仍不失为一种重要的辅助治疗手段。
链接:http://www.lewenyixue.com/2024/07/30/%E5%A4%A7%E5%89%82%E9%87%8F%E7%BB%B4%E7%94%9F%E7%B4%A0C%E5%9C%A8%E8%82%BF%E7%98%A4%E6%82%A3%E8%80%85%E5%BA%94%E7%94%A8%E7%9A%84%E5%AE%89%E5%85%A8%E6%80%A7%E8%A7%82%E5%AF%9F/










赶快来坐沙发