【论著】1 096例早期胃癌淋巴结转移危险因素分析及列线图预测模型的构建
引用本文: 周瑜凝, 姜文超, 高晓东, 等. 1 096例早期胃癌淋巴结转移危险因素分析及列线图预测模型的构建[J]. 中华胃肠外科杂志, 2024, 27(7): 711-717. DOI: 10.3760/cma.j.cn441530-20230922-00103.
作者: 周瑜凝 姜文超 高晓东 汪学非 孙益红
作者单位:复旦大学附属中山医院普通外科
摘要
目的 分析早期胃癌淋巴结转移的危险因素,并建立列线图预测模型。
方法 采用回顾性观察性研究方法,收集2016年1月至2022年7月在复旦大学附属中山医院接受胃癌根治术联合标准D 1 淋巴结清扫,且术后病理为早期胃癌患者的临床资料。根据有无淋巴结转移将患者分为转移组与无转移组,比较两组患者临床病理特征,并将差异有统计学意义的数据纳入多因素logistic回归分析,进一步评估早期胃癌发生淋巴结转移的独立危险因素。按6∶4的比例将患者分为训练集和验证集。选取独立危险因素建立列线图预测模型,同时选取日本胃癌协会(JGCA)指南中内镜切除适应证的相关因素以相同方式建立模型,分别绘制受试者工作特征(ROC)曲线,通过曲线下面积(AUC)比较两者预测效能差异。
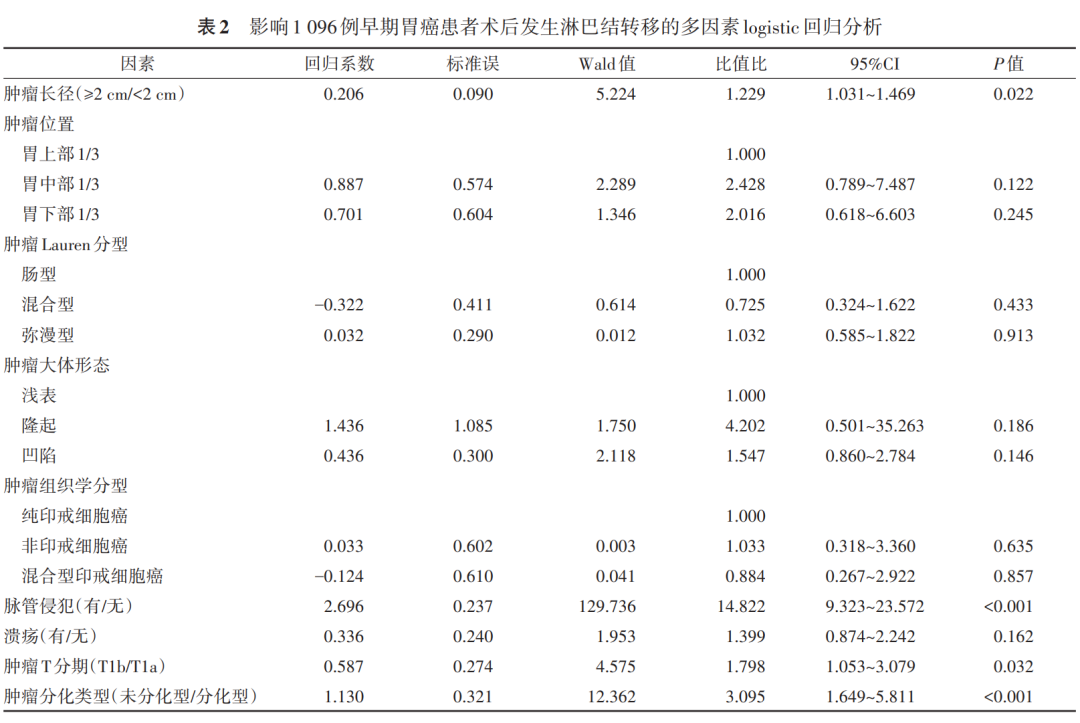
结果 共纳入1 096例早期胃癌患者,男性750例,女性346例;年龄(61.4±10.9)岁;肿瘤长径(23.8±11.4) mm。其中淋巴结转移阳性患者188例(17.2%),N1、N2和N3期分别为109、42和37例,T1a和T1b期分别为462和634例。单因素分析显示,肿瘤长径、肿瘤位置、肿瘤Lauren分型、肿瘤大体形态、肿瘤组织学分型、有无脉管侵犯、有无溃疡、肿瘤分化类型和肿瘤T分期与早期胃癌根治术后淋巴结转移有关(均 P <0.05)。Logistic多因素分析显示,脉管侵犯(OR=14.822,95%CI:9.323~23.572, P <0.001)、肿瘤未分化(OR=3.095,95%CI:1.649~5.811, P <0.001)、肿瘤T1b期(OR=1.798,95%CI:1.053~3.079, P =0.032)和肿瘤长径≥2 cm(OR=1.229,95%CI:1.031~1.469, P =0.022)均是影响早期胃癌淋巴结转移的独立危险因素。训练集与验证集的基线均衡性一致(均 P >0.05)。基于以上变量所构建的早期胃癌淋巴结转移列线图预测模型在训练集和验证集验证所得的AUC值分别为0.880(95%CI:0.849~0.911)和0.881(95%CI:0.841~0.921),且明显优于基于JGCA指南内镜切除适应证的预测效能(AUC=0.777,95%CI:0.746~0.809, P <0.001)。
结论 对于存在脉管侵犯,肿瘤未分化、T1b期和长径≥2 cm的早期胃癌患者,应警惕术后淋巴结转移风险;本研究构建的预测模型能够更有效地预测早期胃癌淋巴结转移。
随着内镜诊疗技术的不断发展,以内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)和内镜黏膜切除术(endoscopic mucosal resection,EMR)为代表的内镜技术成为早期胃癌的治疗方式之一 [1] 。在符合特定适应证的前提下,内镜治疗在安全性和患者预后生存方面均与外科手术无明显差异 [2] 。然而,无论何种手术方式都应建立在肿瘤根治的基础之上,淋巴结是否转移是影响治疗方式选择的决定因素。如何更加精准地预测早期胃癌患者是否发生淋巴结转移,避免不恰当的“微创”手段,防止肿瘤残留,成为目前早期胃癌的主要研究方向之一。
目前,已有研究在探讨早期胃癌淋巴结转移的影响因素,包括年龄、肿瘤大小、浸润深度、分化程度和有无溃疡等 [3⁃10] 。中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)和日本胃癌学会(Japanese Gastric Cancer Association,JGCA)指南中也将肿瘤长径、有无溃疡、分化类型和浸润深度作为标准判断是否适合内镜下切除 [1,11] 。然而,国内已经发表的早期胃癌淋巴结转移相关预测模型多以小样本为基础,对纳入模型的因素选择可能存在偏差 [12] ;随着病理诊断技术的提高,出现了更多能够为术前诊断提供依据的参考因素如脉管浸润等,其有效性仍有待探讨 [13⁃14] 。因此,本研究收集了在复旦大学附属中山医院行胃癌根治术联合标准D 1 淋巴结清扫术且术后病理证实为早期胃癌的患者临床病理资料,分析影响早期胃癌淋巴结转移的危险因素,旨在建立更有效的预测模型,从而在术前进行准确规范的评估。
一、研究对象
本研究为回顾性观察性研究。
纳入标准:(1)术后病理诊断为早期胃癌;(2)临床资料和术后病理资料完整;(3)术前进行内镜活检。排除标准:(1)术前进行接受放化疗;(2)合并其他原发肿瘤,如肺癌、乳腺癌、肝癌和淋巴瘤等。
按照上述标准,回顾性收集了2016年1月至2022年7月期间,在复旦大学附属中山医院行胃癌根治术联合标准D 1 淋巴结清扫的连续病例共1 096例患者的临床病理资料。本研究通过复旦大学附属中山医院伦理委员会审批通过[审批号:B2023⁃159(2)]。
二、内镜切除适应证
依据JGCA指南,早期胃癌患者内镜下切除的绝对适应证包括:肿瘤长径≤2 cm、无溃疡、分化型且浸润局限于黏膜内 [1] 。扩大适应证包括:(1)肿瘤长径≤3 cm、有溃疡、分化型的黏膜内癌;(2)长径≤3 cm的黏膜下癌;(3)肿瘤长径>2 cm,无溃疡、分化型的黏膜内癌;(4)肿瘤长径≤2 cm、无溃疡、未分化型的黏膜内癌 [1] 。
三、观察指标和评价标准
通过查阅病史记录以及手术切除标本病理报告,收集患者年龄、性别、肿瘤长径、肿瘤部位、形态、组织学分型、Lauren分型、有无溃疡、分化类型、浸润深度、有无脉管癌栓等临床病理资料。
1.肿瘤部位:依据解剖结构分为胃上部1/3(U)、胃中部1/3(M)和胃下部1/3(L)三部分。
2.肿瘤形态:根据巴黎分型,分为隆起型、浅表型和凹陷型 [15] 。
3.分化类型:依据JGCA2010年分型指南分为分化型和未分化型,其中分化型包括乳头腺癌、管状腺癌,未分化型包括低分化腺癌、黏液腺癌和印戒细胞癌 [16] 。
4.浸润深度:分为肿瘤局限于黏膜层内(T1a)和肿瘤浸润黏膜下层(T1b)。
5.脉管侵犯:包括血管、淋巴管转移以及周围神经侵犯。
6.组织学分型:根据世界卫生组织(World Health Organization,WHO)病理分型标准和欧洲共识,将患者按照印戒细胞含量分为3组:(1)纯印戒细胞癌(pure signet⁃ring cell carcinoma,p⁃SRCC),即主要成分(>50%)为印戒细胞;(2)混合型印戒细胞癌(mixed signet⁃ring cell carcinoma,m⁃SRCC),即含有少量印戒细胞(10%~50%);(3)非印戒细胞癌(non signet⁃ring cell carcinoma,NSRC),即印戒细胞含量少于10% [17-18] 。
四、统计学方法
数据使用统计软件SPSS26.0处理。分类变量用[例(%)]表示,组间比较采用Pearson χ 2 检验。正态分布的计量资料用 x±s 表示,组间比较使用 t 检验。缺失值已在表格中标出且未纳入统计分析。将单因素分析后具有统计学意义的变量采用二元logistic回归模型进行多因素分析, P <0.05为差异有统计学意义。
以随机数字法按6∶4的比例将患者分成训练集(647例)和验证集(449例)。将多因素分析后有统计学意义的独立危险因素纳入中山队列诊断标准,使用R软件中的“rms”包建立基于预测因素的列线图。采用一致性指数(C⁃index)和受试者工作特征(receiver operating characteristic curve,ROC)曲线下面积(area under the curve,AUC)来评价该预测模型的诊断效能。采用Delong检验判断训练集和验证集模型差异是否具有统计学意义。同时对JGCA指南 [11] 内镜下切除手术适应证的相关指标,即:肿瘤长径、有无溃疡、浸润深度和分化类型以同样的方法进行评估并纳入ROC曲线,通过比较两种模型的AUC比较两者的预测效能。
一、全组患者临床病理特征
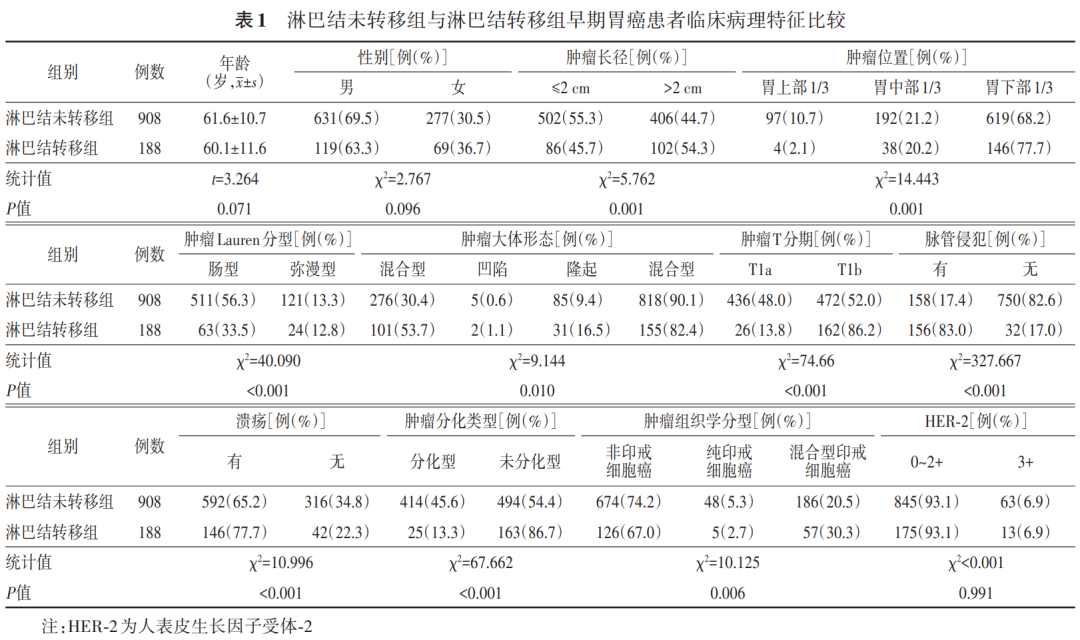
本研究共纳入1 096例早期胃癌患者,男性750例,女性346例;年龄(61.4±10.9)岁;肿瘤长径(23.8±11.4) mm。其中淋巴结转移阳性患者188例(17.2%),N1期、N2期、N3期分别为109、42和37例,T1a期和T1b期分别为462和634例。有无淋巴结转移两组患者临床病理特征的比较见表1。
二、影响早期胃癌淋巴结转移的因素分析
表1显示:肿瘤长径、位置、Lauren分型、大体形态、肿瘤T分期、有无脉管侵犯、有无溃疡、分化类型和组织学分型是早期胃癌患者发生淋巴结转移的影响因素(均 P <0.05)。多因素分析结果显示:肿瘤长径>2 cm、有脉管侵犯、肿瘤T1b期和未分化型是早期胃癌淋巴结转移的独立危险因素(均 P <0.05)。见表2。
三、早期胃癌淋巴结转移的预测模型建立和评价
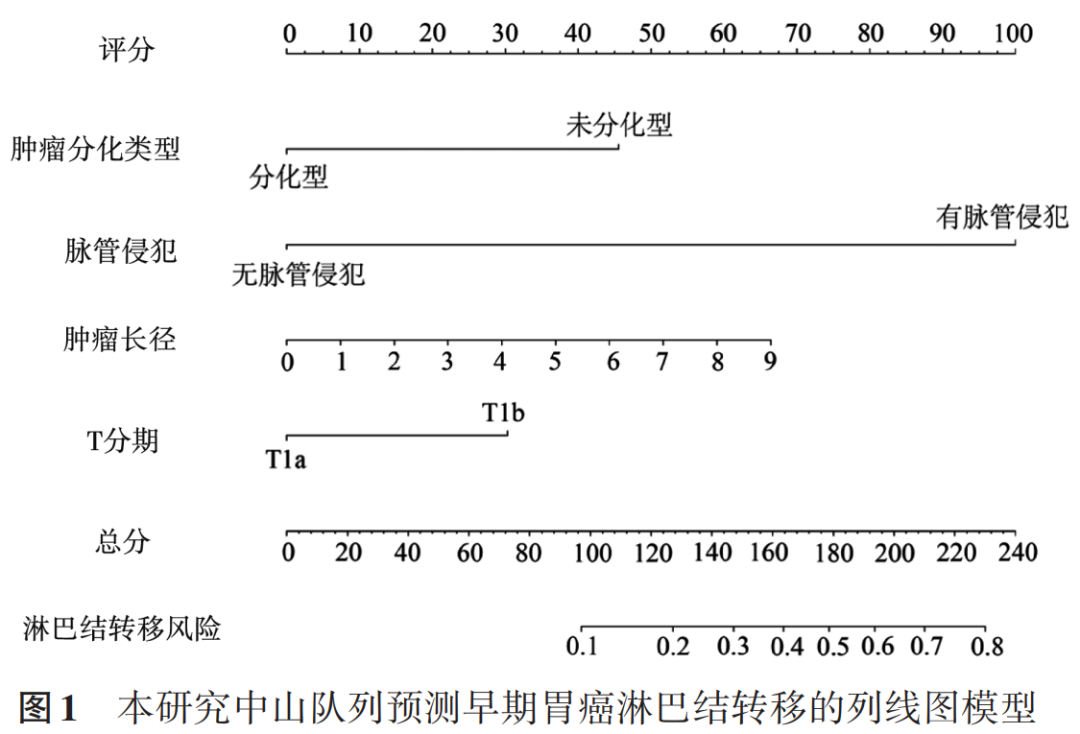
1.预测模型的建立:从所有样本中按6∶4随机抽取样本分别构成训练集(647例)和验证集(449例),两数据集的临床病理因素特征比较见表3。根据多因素分析结果,将肿瘤长径、有无脉管癌栓、浸润深度和分化类型这4个危险因素纳入预测淋巴结转移预测模型,以训练集数据为基础绘制列线图。按患者的病理结果作垂线得到每个影响因素的评分,4个评分相加得到总分,并向预测概率的标尺作垂线,得到该患者发生淋巴结转移的概率,见图1。
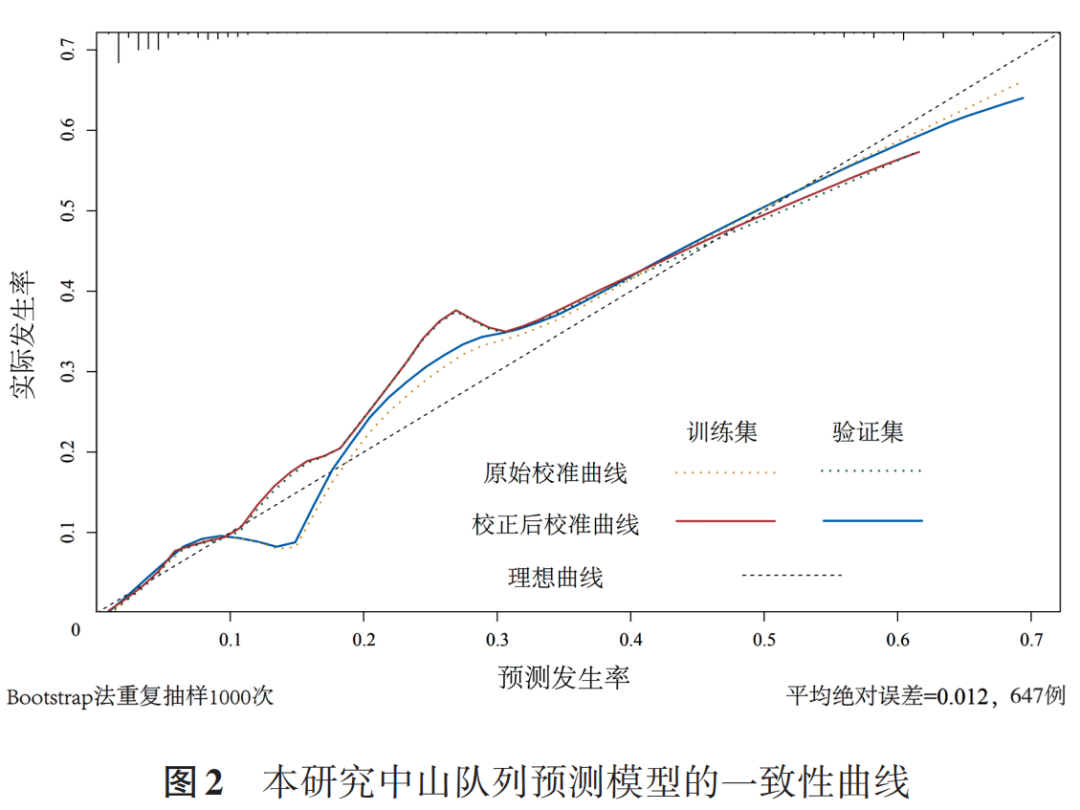
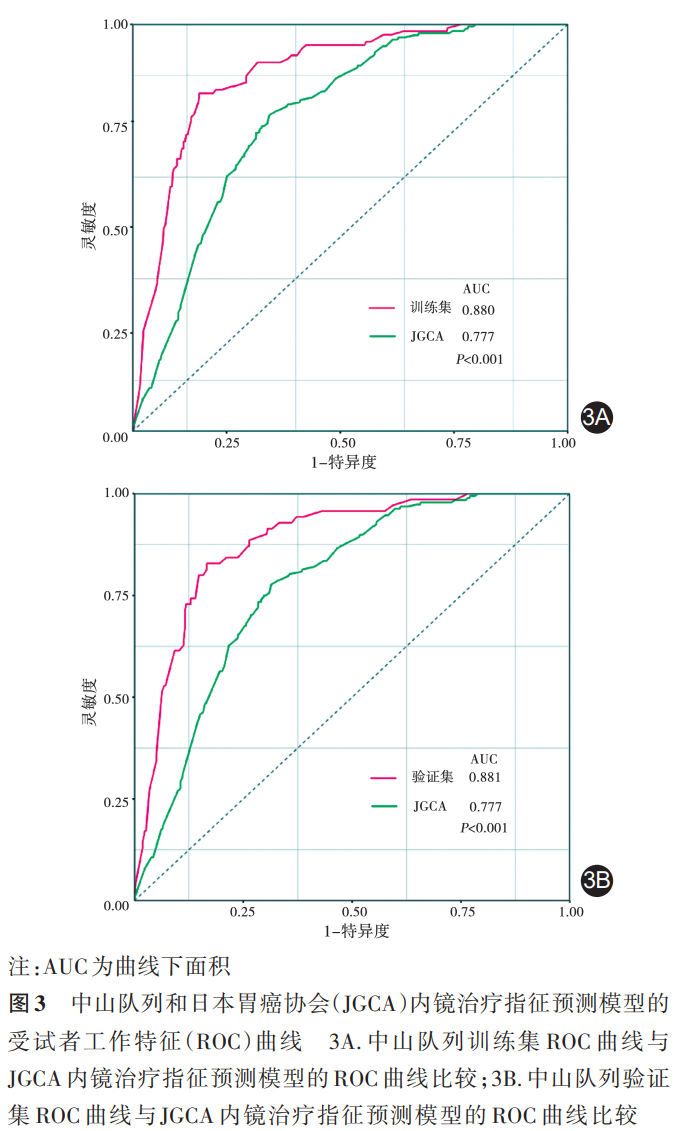
2.预测模型的评价:同时绘制一致性曲线来判断该模型诊断效能,见图2。X轴表示由列线图预测的淋巴结转移概率,Y轴表示实际的概率,得到训练集的一致性指数(C⁃index)为0.880。将验证集的患者信息代入该预测模型,得到验证集的一致性曲线,其一致性指数为0.881。
基于以上预测模型,进行ROC曲线的绘制;同时对JGCA指南内镜下切除手术适应证的相关指标,即:肿瘤长径、有无溃疡、浸润深度和分化类型进行评估并纳入ROC曲线。对两者进行比较分析后发现,AUC由JGCA标准的0.777(95%CI:0.746~0.809)提高至中山队列的0.880(95%CI:0.849~0.911, P <0.001)。验证集队列得到曲线下面积为0.881(95%CI:0.841~0.921, P <0.001),Delong验证得到两者ROC曲线差异无统计学意义( P =0.817),该模型的一致性较好。见图3。
中山队列中符合JGCA内镜治疗的绝对或扩大适应证的患者有192例,其中2例(1.0%)发生淋巴结转移,均为长径≤2 cm的未分化型黏膜内癌;符合相对适应证(长径≤3 cm的分化型黏膜下癌)的患者202例,其中20例(9.9%)发生淋巴结转移。明确淋巴结是否转移是决定早期胃癌治疗方案的关键。本研究依据1 096例中山胃癌队列,开发了一个新的预测模型:基于多因素分析结果,将4个独立危险因素,即有无脉管侵犯及肿瘤分化类型、肿瘤T分期和肿瘤长径纳入构建列线图预测模型,其ROC的AUC达到0.879,具有较高的准确性和预测效能,在治疗决策方面具有巨大的潜力。
目前,早期胃癌内镜下治疗的指征主要是依据JGCA指南,即肿瘤长径、分化类型、浸润深度以及有无溃疡 [1] 。肿瘤长径、分化类型以及浸润深度均被认为是影响早期胃癌淋巴结转移的独立危险因素,对淋巴结转移的预测价值得到了广泛认可 [1,6,16,19⁃22] 。总体上看,转移率随着分化程度的降低而升高,但印戒细胞型早期胃癌一般预后较好 [23⁃24] ;进展期则预后极差,预示着印戒细胞癌的预后可能与肿瘤分期有关 [25] 。随着肿瘤发生发展,印戒细胞所表现出的不同生物学行为仍然需要更多的研究去探索。
近年来,关于脉管侵犯在早期胃癌淋巴结转移中的预测价值进行了广泛的研究和讨论。许多研究表明,存在脉管侵犯的早期胃癌患者更有可能发生淋巴结转移 [13⁃14] 。目前,包括D2⁃40在内的淋巴管标记物也大大提高了术前诊断脉管侵犯的准确性 [26] 。本研究分析结果也发现,脉管侵犯是淋巴结转移的独立危险因素(OR=14.822,95%CI:9.323~23.572, P <0.001),但仍需要进一步的研究来更全面评估其临床应用的准确性和可靠性。未来我们可以通过更大规模的队列研究和更深入的分子生物学分析,来进一步探讨脉管侵犯在早期胃癌预后和治疗中的作用。
溃疡在早期胃癌淋巴结转移中的预测作用一直存在争议。JGCA指南中将无溃疡作为内镜治疗的绝对适应证标准之一,可能与溃疡导致的穿孔率增加有关 [1] 。JCOG0607临床试验发现,当病灶有溃疡且肿瘤长径>3 cm时,发生出血或穿孔的比例大大提高 [27⁃28] 。Haruta等 [29] 、闵丛丛等 [30] 和金鑫等 [31] 的研究认为,溃疡是早期胃癌淋巴结转移的独立危险因素;而本研究发现,溃疡患者更易发生淋巴结转移( P <0.001),但并非影响早期胃癌淋巴结转移的独立危险因素(OR=1.399, P =0.162),这与Cai等 [14] 的研究结论一致。可能与我们研究的样本量有限有关。溃疡与早期胃癌淋巴结转移的关系有待更多的多中心、大样本临床研究和基础研究去证实。
本预测模型与JGCA标准不同之处在于,将有无溃疡更换为有无脉管侵犯,使AUC由JGCA标准的0.763提高至中山队列的0.879( P <0.001),一致性指数(C⁃index)为0.881,显著提高了预测水平且具有较高的准确性。但本模型仅纳入了一些常见的病理因素,导致预测效能具有一定的局限性,未来可以纳入其他特征性的血清生物标记物如ITIH1、FZD6和DPP10等来进一步提高预测效能 [32] 。另外,本研究仅使用本中心数据进行内部验证,未来我们将纳入多中心数据进行外部验证以提高预测模型的可靠性和普适性。
利益冲突 所有作者声明无利益冲突
作者贡献声明 周瑜凝:研究方案设计、数据采集和分析、文章撰写;姜文超:数据采集;高晓东、汪学非和孙益红:研究方案设计和指导、对文章的知识性内容作批评性审阅、获取研究经费
滑动阅读参考文献
链接:http://www.lewenyixue.com/2024/07/30/%E3%80%90%E8%AE%BA%E8%91%97%E3%80%911%20096%E4%BE%8B%E6%97%A9%E6%9C%9F%E8%83%83%E7%99%8C%E6%B7%8B%E5%B7%B4%E7%BB%93%E8%BD%AC%E7%A7%BB%E5%8D%B1/




 知道|国家药品不良反应监测年度报告(2024年)
知道|国家药品不良反应监测年度报告(2024年)
赶快来坐沙发