R-loop介导的肿瘤微环境新思路
今天研究分享的这篇文章名为“ Aberrant R-loop–mediated immune evasion, cellular communication, and metabolic reprogramming affect cancer progression: a single-cell analysis ” 异常的 R 环介导的免疫逃避、细胞通讯和代谢重编程影响癌症进展:单细胞分析。 于202 1年1月 在 Molecular Cancer 上发表IF 为37.3,Q1区。

一、背景
这篇文章利用来自肺腺癌(LUAD)的单细胞RNA测序数据集,构建了一个R环评分模型,以表征与EGFR突变、组织起源和TNM分期相关的R环状态。R环是非B型DNA结构,由DNA-RNA杂交配对和置换的单链DNA(ssDNA)形成的三链结构。它可能干扰DNA复制、修复和转录,从而损害基因组完整性和功能。R环在哺乳动物基因组中普遍存在,参与多种生物过程,产生积极和消极的效应。生理性R环有助于DNA修复、细胞增殖和分化、RNA转录和加工,以及调节基因表达和DNA甲基化。此外,R环还在基因调控、端粒稳定、DNA复制和组蛋白修饰等方面发挥着重要作用。已有1000多种R环调节剂报道。研究发现,R环调节因子BRCA2的缺失可导致R环的异常积累,从而引发BRCA2缺陷细胞染色体异常。
二、介绍
本研究利用来自肺腺癌(LUAD)的单细胞RNA测序(RNA-seq)数据集,建立了一个R-loop评分模型,通过基于与EGFR突变、组织起源和TNM分期相关的已鉴定的R-loop调节因子来表征R-loop状态。研究的研究发现,R-loop评分可以反映肿瘤微环境特征,并预测抗肿瘤治疗效果。低R环评分与不良结局、抗癌治疗(如靶向治疗和化疗)的耐药性以及对免疫治疗无反应相关联。特别重要的是,研究揭示了由R环调节因子介导的R环分布变化对LUAD发展的因果关系。综上所述,研究的研究为利用靶向R环或R环调节剂改善癌症治疗临床反应提供了理论基础。
结果
恶性细胞的 R-loop 评分与 LUAD 的疾病结局相关
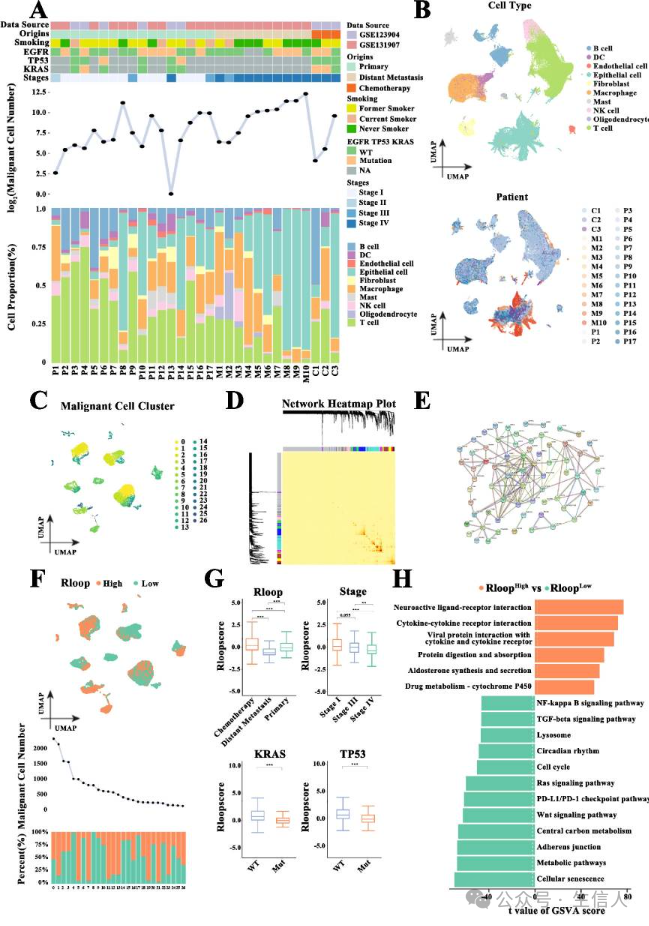 图1
图1
为了探索 R-loop与LUAD进展之间的关系, 研究首先整合了两个独立的单细胞 RNA-seq数据集(GSE123904和GSE131907)(图1A)。 通过质量控制方法, 研究从 92,842个细胞中提取了26,248个RNA转录本,随后利用主成分分析(PCA)和UMAP方法获得了57个细胞簇。 这些细胞簇已注释为10种已知的细胞类型,并区分了恶性细胞和潜在的非恶性细胞群。 研究评估了整个转录组数据中的染色体拷贝数变异( CNV),结果显示恶性细胞和上皮细胞的上皮评分明显高于非恶性细胞,而恶性细胞在不同簇中被聚集到与其样本来源相对应的不同簇中,而非恶性细胞在患者之间没有表现出明显的差异(图1B-C)。
研究使用 WGCNA筛选出与EGFR突变、组织起源和TNM分期相关的4个模块(图1D)。 KEGG富集分析显示,这些来自四个模块的92个调节因子在DNA损伤/修复相关通路中显著富集(图1E)。 基于这些鉴定基因的表达谱, 研究构建了评分模型来表征 R-loop状态。 癌症转移样本的恶性细胞亚群(例如,亚群2、4、6、8和10)显示出低R环评分(图1F),而来自接受化疗的患者的恶性细胞具有明显较高的R-loop评分(图1G)。 根据中位R-loop评分将恶性细胞分为R-loop评分高或低的组。 两组在富集通路上均有显著差异,其中肿瘤进展相关信号通路主要富集在低分组(图1H) 。
loop 评分表征肿瘤免疫逃逸表型 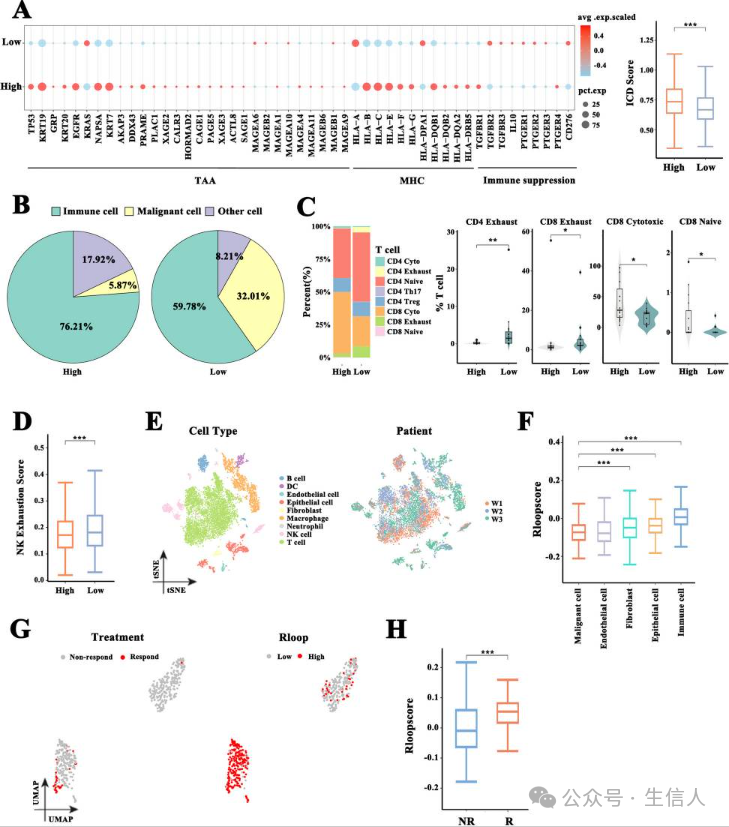
图2
鉴于免疫逃逸是免疫系统无法控制肿瘤进展的关键因素,研究的研究展示了在 GEO数据集中恶性细胞免疫逃逸分子谱的变化(GSE123904和GSE131907)在具有高和低R-loop评分的亚组之间,以及两个不同评分亚组之间富集免疫原性细胞死亡(ICD)通路的评分差异(图2A)。 结果显示,R-loop评分低的恶性细胞比R-loop评分高的恶性细胞更有可能逃避免疫反应,低分R-loop的CD4+和CD8+ T细胞以及NK细胞的耗竭评分显着增加(图2B-D)。
研究采用了单细胞 RNA-seq数据(GSE146100)。通过降维聚类和标注后(见图2E), 研究计算了每种细胞类型的 R-loop评分(图2F),结果显示,恶性细胞的R-loop评分相当低,与其他细胞类型相比。抗PD-1免疫治疗有反应的患者的恶性细胞几乎完全聚集在高R-loop评分亚组中(图2G),这些患者恶性细胞的R-loop评分明显高于对这种治疗无反应的患者(图2H),这表明R-loop评分可以表征肿瘤免疫逃逸表型,并作为LUAD免疫治疗结果的预测因子。
R-loop重塑TME中的细胞间相互作用和细胞因子信号转导活性
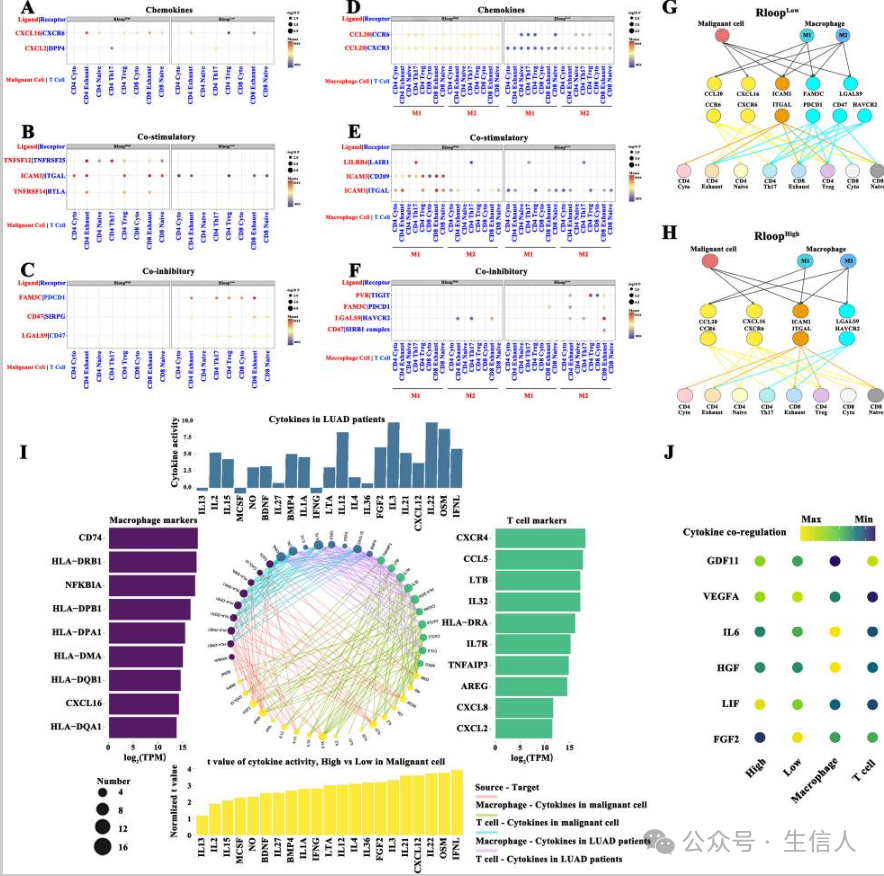
由于细胞间相互作用是抗肿瘤疗效的关键因素,研究注释了 T 细胞亚型和巨噬细胞 ,使用单细胞 RNA-seq 数据集进行细胞通讯分析R-loop 评分与恶性细胞 (如 CXCL16 和 CXCL2 )的趋化因子水平显著呈正相关(图 3A),高 R-loop评分明显促进了恶性细胞产生的共刺激分子,包括TNFSF12、ICAM1和TNFRSF14 (图3B),同时, R-loop高分细胞中的共抑制信号明显降低 (图3C),恶性细胞与 T细胞之间通过FAM3C和PDCD1、CD47和SIRPG以及LGALS9和CD47等共生分子的通讯增强,导致T细胞耗竭 (图3D)。 R-loop评分模式下的巨噬细胞对T细胞的共抑制和共刺激信号显示出不同的影响 (图3E-F)。此外还展示了 R-loop评分模式下恶性细胞-巨噬细胞通讯的差异。巨噬细胞可以与恶性细胞协同作用,激活R-loop评分低的T细胞,包括耗竭的T细胞和Treg细胞 (图3G-H)。研究发现 21 个细胞因子相关通路,在高 R 环评分的恶性细胞中被显着激活,并且 T 细胞和/或巨噬细胞中标记基因的水平 呈正相关(图 3I),高 R环评分和低R环评分之间细胞因子信号通路 (如 GDF11、VEGFA和IL6 )激活的差异有助于 T细胞和/或巨噬细胞内的协同调节作用 (图3J)。
R-loop 影响 LUAD 对 TKI 治疗的反应
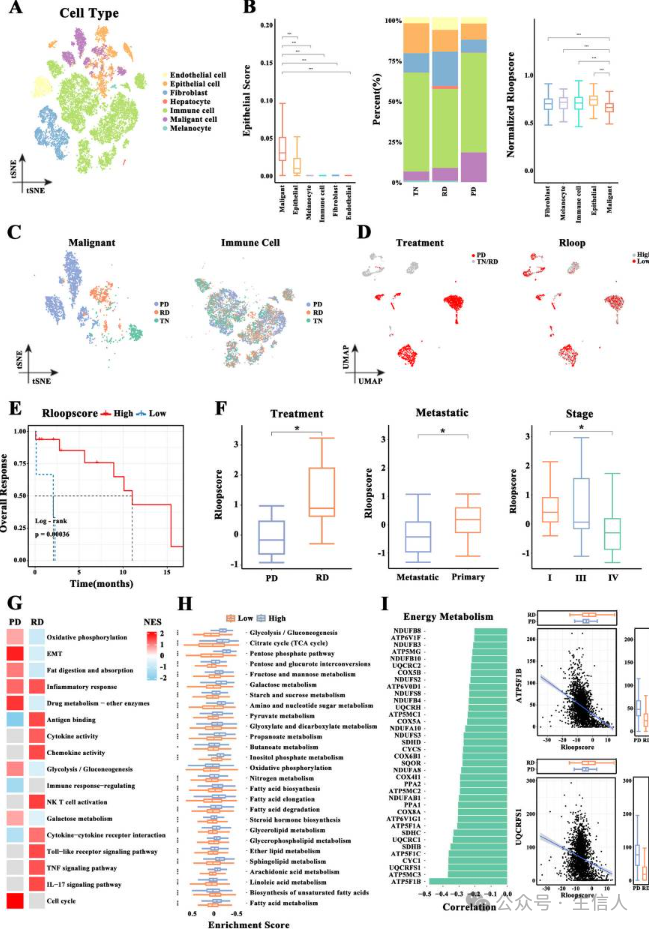
图4
鉴于耐药性通过代谢重编程限制了 TKI等药物的临床疗效 ,收集了一个单细胞数据集,接受 TKI 治疗的 LUAD 患者的 49 个组织样本 。获得几个细胞簇,并分别注释为6种细胞类型(图4A),对 TN (开始靶向治疗之前)、 RD (完全或部分响应状态)和 PD (疾病进展状态)亚组细胞簇分布的分析显示,恶性细胞对 TKI具有显著的高度特异性,并且在PD亚组中显著富集 (图4B-C),根据 92个R环调节因子的表达谱计算恶性细胞的R环评分。R-loop评分低的恶性细胞主要来自PD样本 (图4D),根据恶性细胞的 R-loop评分患者分为两个亚组 ,评分高的患者在生存率方面具有显著优势(图4E),转移性和晚期肿瘤的 R环评分明显较低,RD患者的R环评分显著升高 (图4F)。根据 R-loop评分和TKI等分层因素分别进行GSEA。炎症反应通路和免疫相关通路在R环评分高的RD样本中明显富集,而代谢相关通路在R环评分低的RD样本中显著富集 (图4G),对代谢相关通路进行 GSVA ,负责肿瘤进展的能量代谢途径在具有低 R 环评分的样品中显着富集 (图4H),能量代谢相关基因在 R-loop评分低的样品中上调,其表达与R-loop评分呈负相关 (图4I)。
R-loop评分与所有癌症的预后密切相关
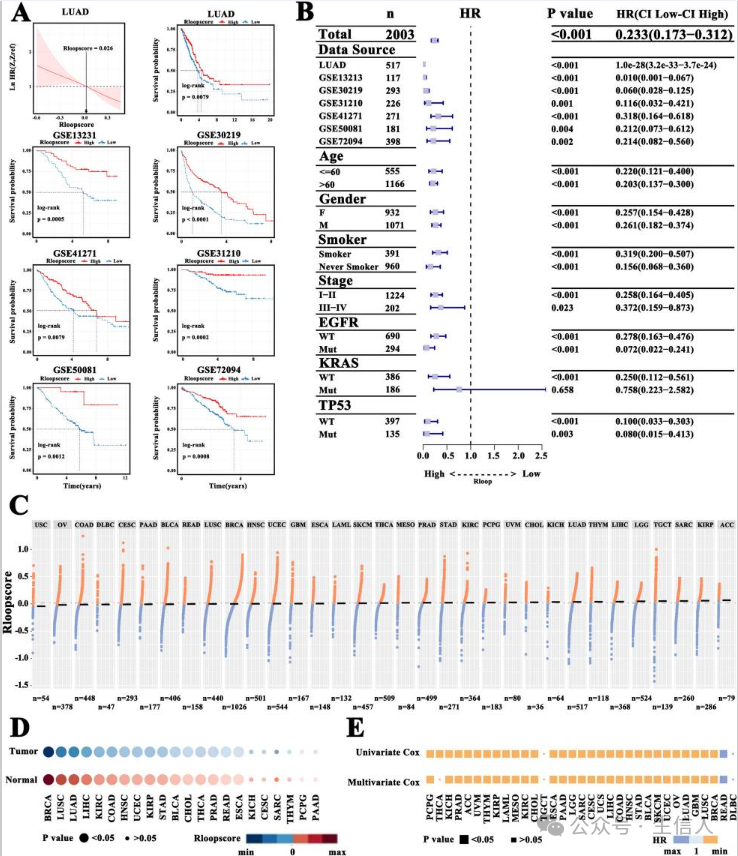
R环在肿瘤进展中起着重要作用, 研究评估了 R环模式的预后 ,与 R-loop 评分相关的风险比 ( HR ) 曲线,发现 R-loop 评分在 LUAD 的 7 个独立队列中高分组的结局明显优于低分组 (图5A),并结合临床因素进行 Cox 比例风险模型的风险比线,R 环评分小于中位值时,Ln ( HR ) 区域的 95% 置信区间 ( CI ) 低于参考线,反之亦然(图5B)。此外,研究评估了来自 TCGA 数据集的 33 种肿瘤类型的的R环评分分布相似 (图5C),根据每种肿瘤类型的 R-loop评分的中位数分为高分和低分亚组 ,与正常组织相比,肿瘤样本的 R-loop 评分显着降低 (图5D),此外,单因素和多因素生存分析进一步表明,低分组在几乎所有肿瘤类型中都与不良结局一致(图5E)。
R-loop 评分可预测治疗预后和治疗反应
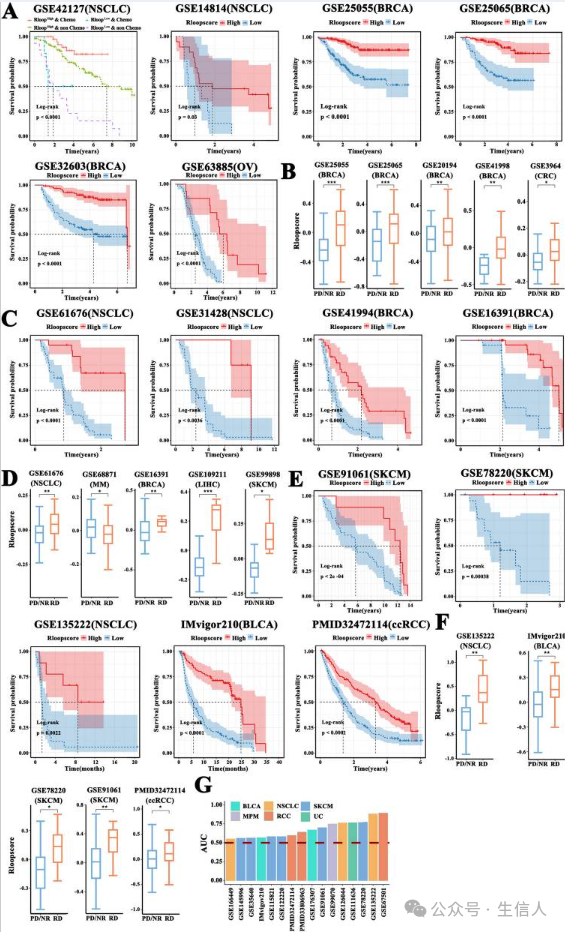
为探索 R-loop评分模型预测癌症患者治疗效果的能力, 提取了 32个肿瘤RNA-seq数据集 ,根据 R-loop 评分的临界值将患者分为两个不同的评分亚组。 在六个独立队列中,两个亚组之间的生存概率存在显著差异 (图6A),通过分析不同程度化疗反应的患者之间 R环评分的差异来评估 研究模型的性能, R-loop 评分在五个队列中 表现出良好的分类性能(图6B),还评估了 R-loop评分模型在接受靶向治疗的患者中的预测性能、高分组结局明显优于低分组 (图6C)。此外, RD组在五个队列中的得分始终高于其他反应型组 (图6D),研究观察到高 R-loop 评分亚型接受免疫治疗的患者预后明显优于低分组患者(图6E)。 值得注意的是,在这五个队列中,RD 组的 R-loop 评分显著高于 NR 组或 PD 组(图6F)。 此外, 研究对免疫治疗 R-loop 评分模型进行了验证,在六种肿瘤类型的 16 个依赖数据集中观察到了曲线下面积值(图6G)。 综合而言, 研究认为 R-loop 评分可能是肿瘤治疗效果的有效预测因子。
FANCI 影响 R 环分布,导致 LUAD 肿瘤进展
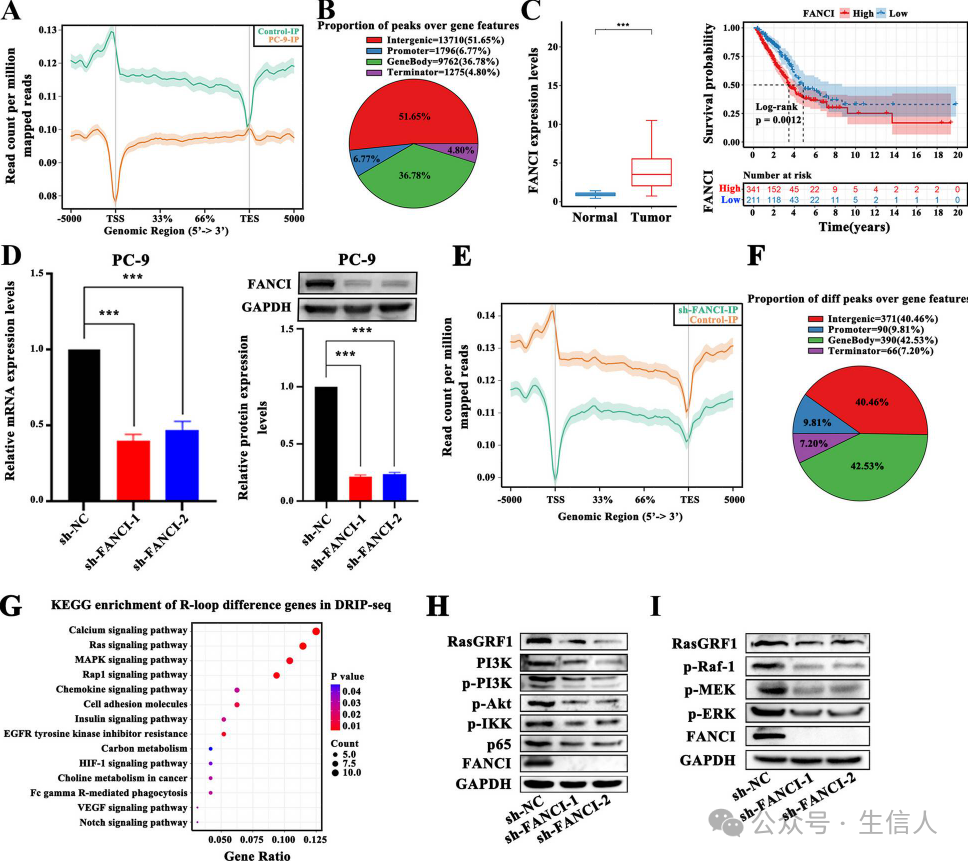 图 7
图 7
研究绘制 LUAD 细胞的 R 环图,发现启动子区域峰处的reads数量高于其他区域(图7A),R-loop峰一半的峰位于基因间区,而11。57%位于启动子和终止子区(图7B),FANCI是一种R环调节因子,在所有的肿瘤类型中均上调,其高表达与不良预后相关(图7C),研究测试了FANCI缺乏对R-loop分布的影响(图7D),而且FANCI敲除明显改变了R-loop的格局,显示出强烈的损失趋势(图7E),研究分析了R环峰数量的差异(图7F),在其他类型的基因区域中都观察到这种变化,此外,具有R-loop变化的基因在癌症进展相关通路中显着富集,例如Ras和MAPK信号通路(图7G)。FANCI 可能通过调节 R 环参与 LUAD 进展,进一步检测了Ras信号通路的活性,发现沉默 FANCI 明显减弱了Ras的活性,导致其下游PI3K/AKT/NF-κB和MAPK/ERK 信号级联在 LUAD 细胞中被强烈抑制(图7H-I)。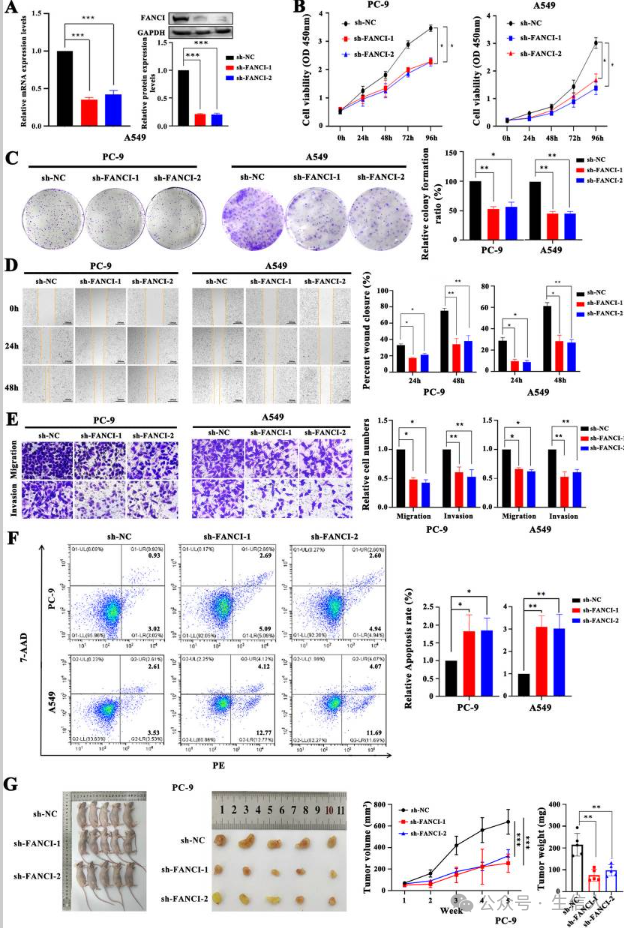
图8
最后,细胞功能实验表明, FANCI耗竭显著抑制了PC-9和A549细胞的细胞增殖、集落形成、迁移和侵袭能力,并促进了细胞凋亡 (图8A-F)。异种移植研究表明, FANCI沉默限制了PC-9细胞在体内形成肿瘤的能力 (图8G)。
结论
综上所述,低分 R环的分布模式与T细胞耗竭相关,可能促进肿瘤的进展,并提供了有关低分R环分布下免疫逃逸和代谢重编程导致药物耐受机制的见解。研究结果有助于加深对R环分布与代谢异质性和TME重塑之间关系的理解。此外,研究进一步突出了异常R环在癌症发展中的因果作用,为设计个体化治疗策略提供了重要参考,并有望推动在R-loop或R-loop调节剂基础上开发更有效的LUAD治疗方案。
【参考文献】
Zhang S, Liu Y, Sun Y, Liu Q, Gu Y, Huang Y, Zeng Z, Tang F, Ouyang Y. Aberrant R-loop-mediated immune evasion, cellular communication, and metabolic reprogramming affect cancer progression: a single-cell analysis. Mol Cancer. 2024 Jan 10;23(1):11. doi: 10.1186/s12943-023-01924-6
链接:http://www.lewenyixue.com/2024/07/26/R-loop%E4%BB%8B%E5%AF%BC%E7%9A%84%E8%82%BF%E7%98%A4%E5%BE%AE%E7%8E%AF%E5%A2%83%E6%96%B0%E6%80%9D%E8%B7%AF/