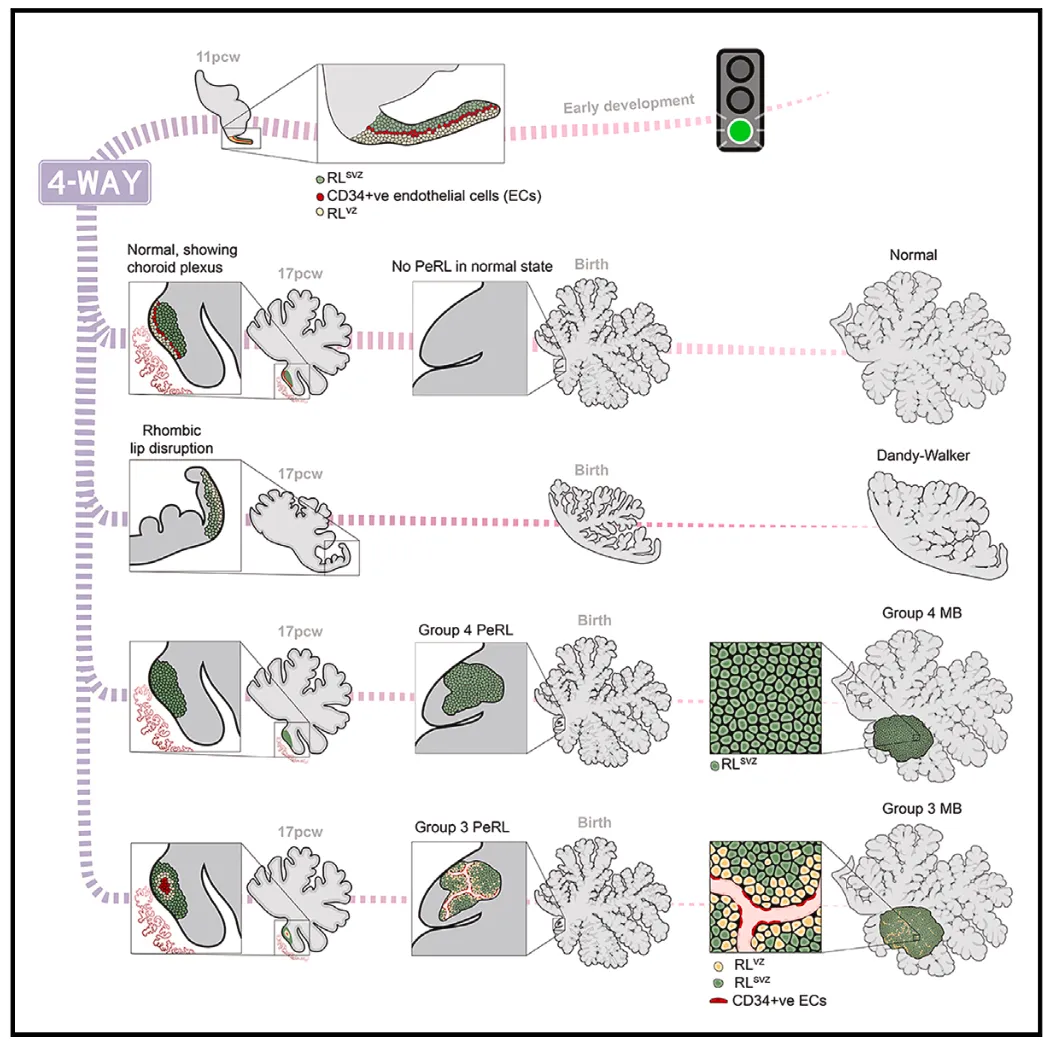
Cell丨靶向PRTG显示对三型髓母细胞瘤的潜在疗效

参考文献:
1. Cavalli, F.M.G., Remke, M., Rampasek, L., Peacock, J., Shih, D.J.H., Luu, B., Garzia, L., Torchia, J., Nor, C., Morrissy, A.S., et al. (2017). Intertumoral Heterogeneity within Medulloblastoma Subgroups. Cancer Cell 31, 737– 754.e6. https://doi.org/10.1016/j.ccell.2017.05.005.
2. Haldipur, P., Aldinger, K.A., Bernardo, S., Deng, M., Timms, A.E., Over- man, L.M., Winter, C., Lisgo, S.N., Silvestri, E., Razavi, F., et al. (2019). Spatiotemporal expansion of primary progenitor zones in the developing human cerebellum. Science 366, 454–460. https://doi.org/10.1126/sci- ence.aax7526.
3. Aldinger, K.A., Thomson, Z., Phelps, I.G., Haldipur, P., Deng, M., Timms, A.E., Hirano, M., Santpere, G., Roco, C., Rosenberg, A.B., et al. (2021). Spatial and cell type transcriptional landscape of human cerebellar devel- opment. Nat. Neurosci. 24, 1163–1175. https://doi.org/10.1038/s41593- 021-00872-y.
4. Wong, Y.H., Lu, A.C., Wang, Y.C., Cheng, H.C., Chang, C., Chen, P.H., Yu, J.Y., and Fann, M.J. (2010). Protogenin defines a transition stage during embryonic neurogenesis and prevents precocious neuronal differentia- tion. J. Neurosci. 30, 4428–4439. https://doi.org/10.1523/JNEUROSCI. 0473-10.2010.
5. Haldipur, P., Bernardo, S., Aldinger, K.A., Sivakumar, T., Millman, J., Sjo- boen, A.H., Dang, D., Dubocanin, D., Deng, M., Timms, A.E., et al. (2021). Evidence of disrupted rhombic lip development in the pathogenesis of Dandy–Walker malformation. Acta Neuropathol. 142, 761–776. https:// doi.org/10.1007/s00401-021-02355-7.
6. Cheng, Y., Liao, S., Xu, G., Hu, J., Guo, D., Du, F., Contreras, A., Cai, K.Q., Peri, S., Wang, Y., et al. (2020). NeuroD1 Dictates Tumor Cell Differentia- tion in Medulloblastoma. Cell Rep. 31, 107782. https://doi.org/10.1016/j. celrep.2020.107782.
7. Fan, X., Masamsetti, V.P., Sun, J.Q., Engholm-Keller, K., Osteil, P., Stud- dert, J., Graham, M.E., Fossat, N., and Tam, P.P. (2021). TWIST1 and chromatin regulatory proteins interact to guide neural crest cell differenti- ation. eLife 10, e62873. https://doi.org/10.7554/eLife.62873.
责编

制作
排版 | 车洁 校对 | uu
▼滑动查看更多▼
DOI: 10.1016/j.cell.2024.06.011
链接:http://www.lewenyixue.com/2024/07/26/Cell%E4%B8%A8%E9%9D%B6%E5%90%91PRTG%E6%98%BE%E7%A4%BA%E5%AF%B9%E4%B8%89%E5%9E%8B%E9%AB%93%E6%AF%8D%E7%BB%86%E8%83%9E/