Nature | 中山大学张常华:代谢“废物”竟成DNA保护伞,驱动肿瘤放化疗抵抗
撰文:官水木
IF=50.5
推荐度:
亮点:
1 、将代谢 “ 废物 ” 乳酸确定为联结癌症代谢与化疗损伤修复的关键分子桥梁。
2 、发现了一种全新的乳酸转移酶 ——TIP60 。
3 、鉴定出乳酸驱动的 NBS1 K388 乳酸化是同源重组介导 DNA 修复的核心机制。
作为癌细胞独特的代谢需求和适应机制, Warburg 效应 早在 20 世纪 20 年代就被发现,它表明癌细胞会优先利用糖酵解产生能量,同时也导致乳酸的大量累积。 Warburg 效应赋予肿瘤细胞快速增殖的能力,但多数化疗药物正好会破坏快速增殖期的 DNA ,以实现杀伤癌细胞的目标。
为了生存,癌细胞必须迅速修复受损的 DNA 。此前的研究已经发现某些代谢物,如 2- 羟基戊二酸、延胡索酸和琥珀酸的累积,会抑制 DNA 修复并促进肿瘤死亡。然而,对那些有益于 DNA 修复的代谢物科学界却知之甚少。因此,揭示代谢驱动的 DNA 修复机制对于理解肿瘤生存至关重要,并且这些机制可能揭示新的化疗增敏方案。
近日,中山大学的 张常华教授 团队在国际顶级期刊《 Nature 》上 发表了名为 “ NBS1 lactylation is required for efficient DNA repair and chemotherapyresistance ” 的重磅研究文章。该成果揭示了 Warburg 效应在 DNA 损伤修复中的新型作用,将乳酸这一糖酵解 “ 废物 ” 重新定义为肿瘤 DNA 修复的保护伞,从而为抗肿瘤治疗开启了全新视角。
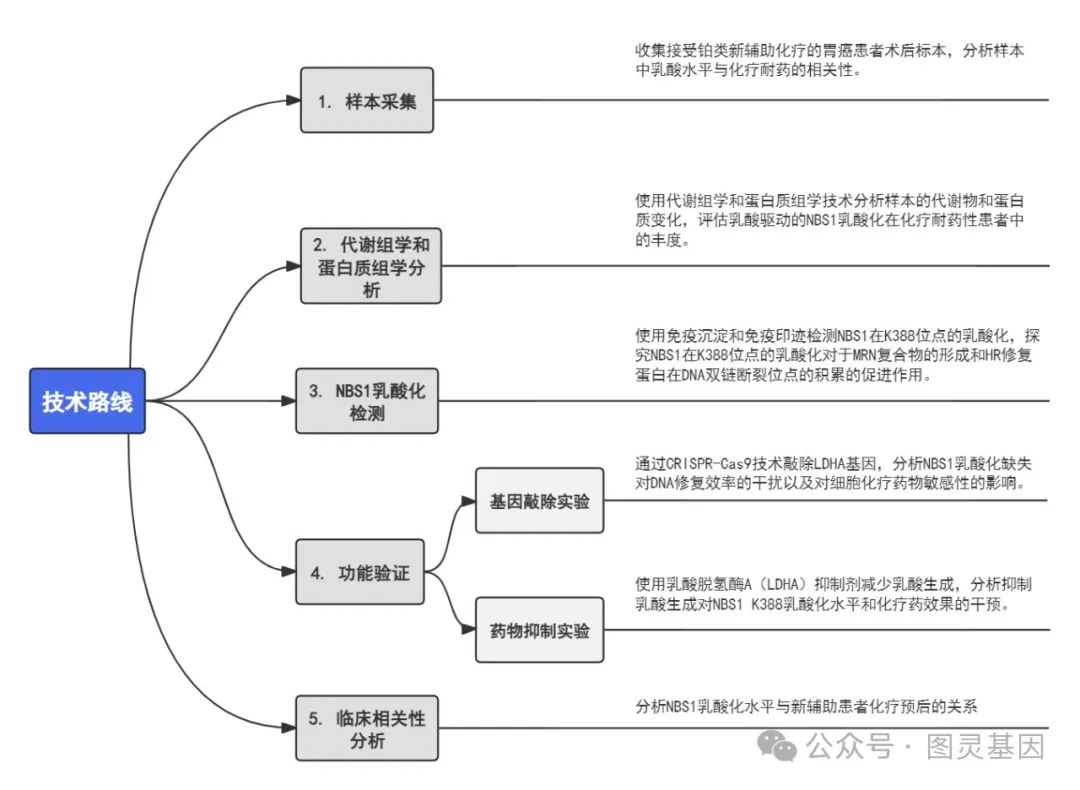
机制图
1 、乳酸助力同源重组( HR )介导的 DNA 修复
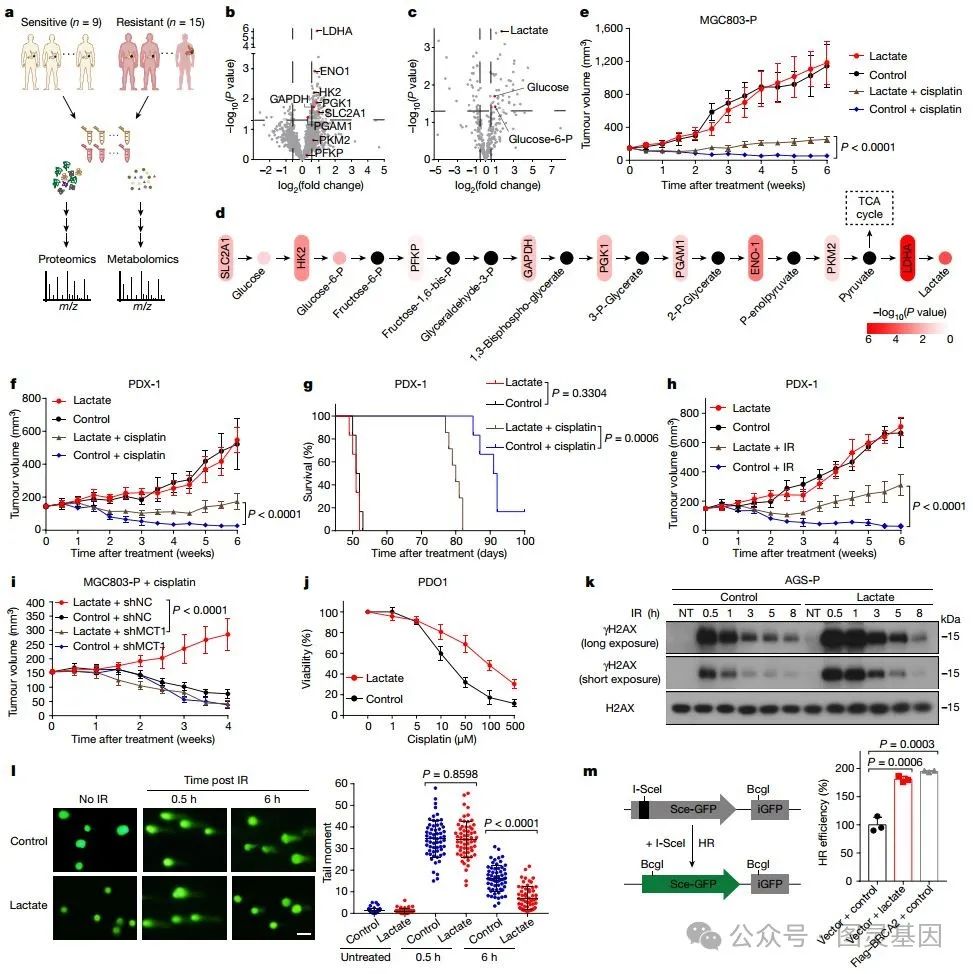
图 1. 乳酸促进 DNA 损伤修复
研究人员首先利用蛋白质组学和非靶向代谢组学分析,惊奇地发现在铂类药物耐药的临床肿瘤标本中,乳酸脱氢酶( LDHA )和乳酸水平显著升高,这表明耐药的癌细胞通过糖酵解途径正大量产生乳酸分子。
在接下来的小鼠模型中,乳酸对肿瘤生长没有影响,但它却削弱了顺铂的治疗效果,并缩短了小鼠的生存时间。另外,乳酸还增强了肿瘤对电离辐射( IR ,可诱导 DNA 损伤)的耐受性。然而,当在肿瘤细胞中抑制乳酸摄取转运蛋白 MCT1 时,乳酸的这些 “ 保护 ” 作用就消失了。
进一步的实验显示,乳酸不仅让患者来源类器官和细胞系对多种 DNA 损伤处理(包括顺铂、依托泊苷、阿霉素和 IR )产生耐受性,还导致 DNA 双链断裂显著增加。通过报告基因实验,研究人员窥见乳酸显著提高了 HR 修复效率,但对非同源末端连接( NHEJ )修复效率的提升较小。这些结果表明,乳酸主要通过增强 HR 修复来帮助肿瘤细胞克服 DNA 损伤。
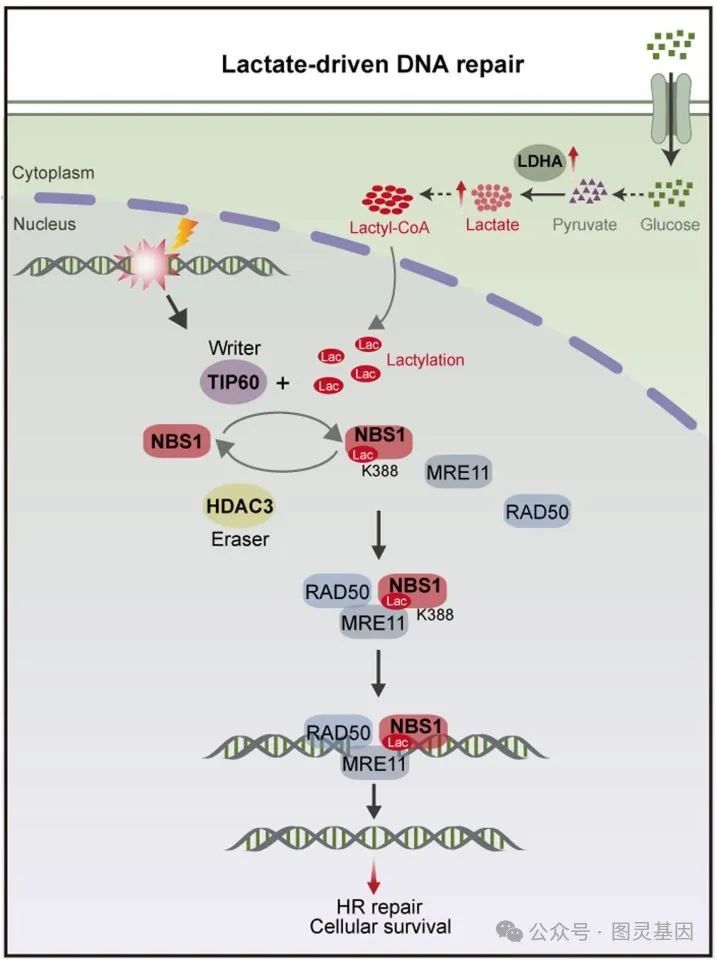
2 、乳酸促进 NBS1 K388 位点乳酸化
图 2. 乳酸诱导 TIP60 介导的 NBS1 K388 乳酸化
乳酸诱导的赖氨酸乳酸化( Kla )是 2019 年才发现的新型蛋白翻译后修饰,是细胞代谢领域的前沿热点。作者顺藤摸瓜,发现化疗耐药的胃癌组织和细胞中 Kla 水平显著升高。乳酸化的蛋白质被招募到 DNA 双链断裂( DSBs )位点,表明乳酸化在 DNA 修复中起重要作用。
为全面掌握 DNA 修复相关的乳酸化,研究者使用 4D 无标记蛋白质组学分析,鉴定出 4028 个乳酸化位点,涉及 1603 种蛋白质,并定量了 2485 个乳酸化位点,涉及 1140 种蛋白质。通过 STRING 数据库分析上调的乳酸化底物中的 DNA 修复蛋白,他们发现 NBS1 在 DNA 损伤感知和修复中 起关键作用。
进一步实验表明, NBS1 在顺铂耐药细胞中乳酸化水平增加。通过 LC-MS/MS 和基因编辑技术,研究者确认了 NBS1 的 K388 位点 被乳酸化,特异性抗体验证了这一修饰。他们还意外发现, TIP60 是一种新型的赖氨酸乳酸转移酶,与 NBS1 直接相互作用并介导 NBS1 的 K388 位点乳酸化。此外, HDAC3 被鉴定为 NBS1 的去乳酸化酶。这表明, TIP60 诱导的 NBS1 K388 乳酸化在 DNA 修复中具有重要功能。
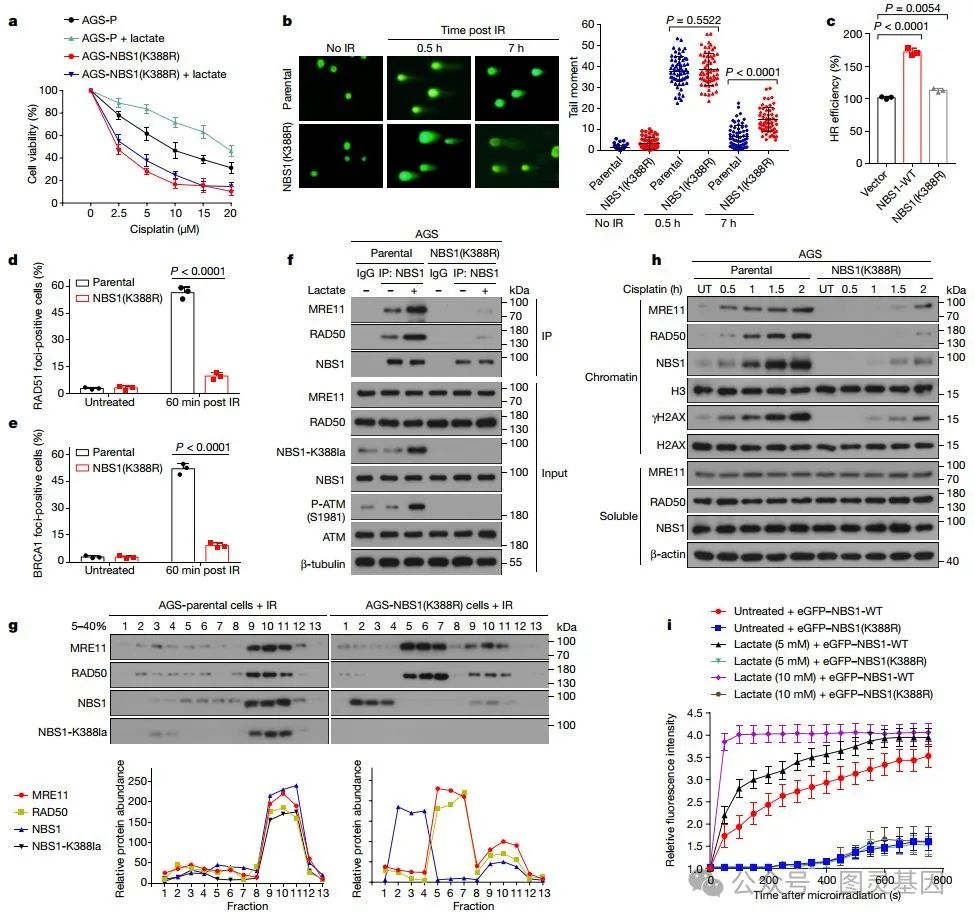
3 、 NBS1 乳酸化推动形成 MRN 复合物
图 3. NBS1 K388 乳酸化促进 DNA 修复和 MRN 复合物形成
研究人员发现当 NBS1 的 K388 位点被乳酸化时,癌细胞对顺铂和 IR 的抗性显著增加。相反,如果这个位点发生突变( K388R ),细胞在接受顺铂或 IR 处理后,存活率显著降低,凋亡率增加。同时, LDHA 的过表达可以增强 AGS-P 细胞(野生型 NBS1 )的抗性,但对 AGS-NBS1 ( K388R ) 细胞(突变 NBS1 )没有影响。作者解释这些结果证明了 NBS1 K388 位点的乳酸化在 DNA 修复中的重要性。
NBS1 是 HR 修复的关键蛋白。野生型 NBS1 的过表达显著提高了 HR 修复效率,而 NBS1 ( K388R )的过表达则没有明显效果。 NBS1 与 MRE11 和 RAD50 形成三聚体 MRN 复合物,该复合物在感知双链断裂和激活 DNA 修复途径中起关键作用。免疫共沉淀实验表明,顺铂处理后, AGS-NBS1 ( K388R ) 细胞中 MRE11-RAD50 与 NBS1 的相互作用显著减少。
另外交联质谱分析显示, NBS1 ( K388R )蛋白与野生型 NBS1 蛋白的交联模式不同,表明 K388R 突变改变了 NBS1 的构象。体外实验进一步表明,乳酸化的 NBS1 与 MRE11 形成直接相互作用,而未乳酸化的 NBS1 则不与 MRE11 相互作用。这些数据表明,通过促进 MRN 复合物形成和 HR 蛋白向损伤位点的募集, NBS1 乳酸化帮助癌细胞有效修复 DNA 损伤,从而提高了它们对放、化疗的抗性。
4 、抑制 NBS1 K388 乳酸化可提高肿瘤疗效
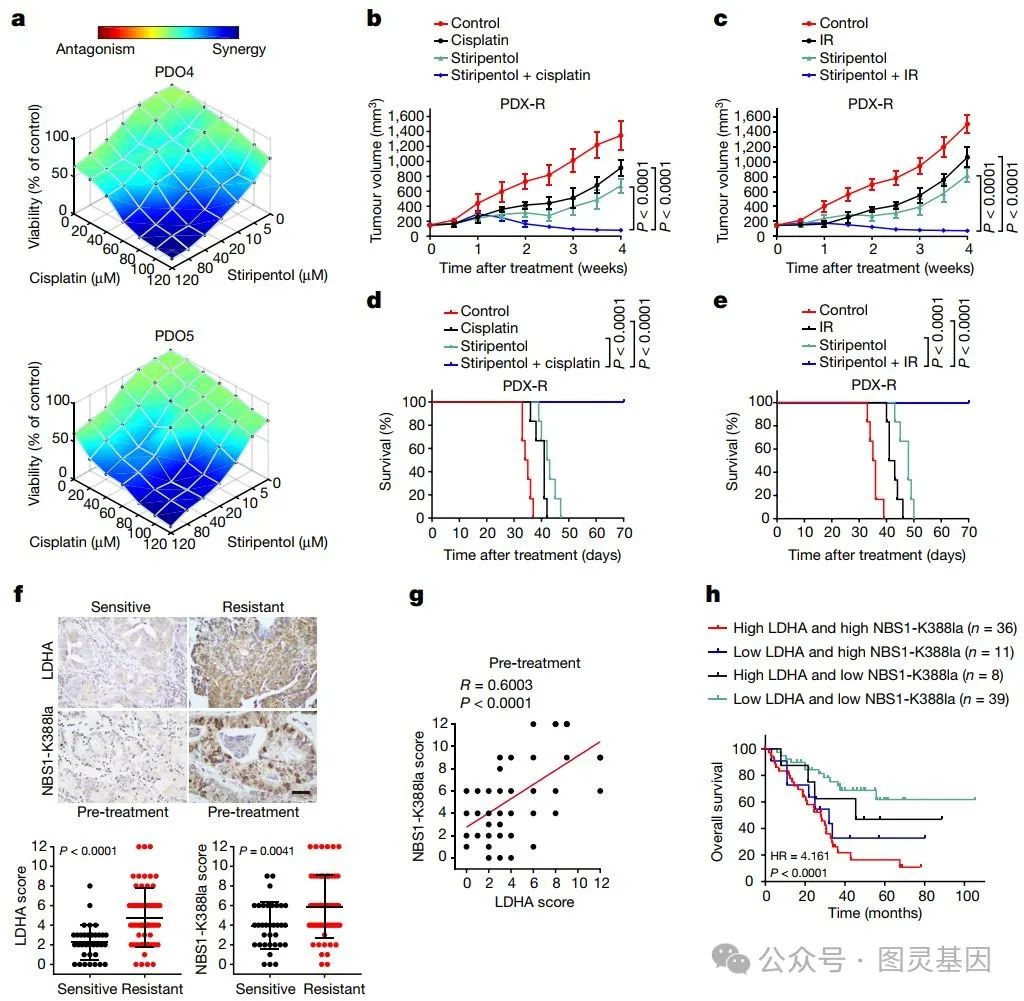
图 4. NBS1 K388 乳酸化在新辅助化疗耐药中的作用
研究人员通过 CRISPR 技术敲除 LDHA 基因,成功减少了乳酸生成和 NBS1 K388 乳酸化。此外,使用 LDHA 抑制剂 也能显著降低乳酸生成和 NBS1 K388 乳酸化。彗星试验显示, LDHA 敲低导致癌细胞中 DNA 修复缺陷,但对 NBS1 突变细胞无影响。这表明 LDHA 抑制通过抑制 NBS1 K388 乳酸化来干扰 DNA 修复。
作者在五个胃癌患者来源类器官( PDO )中测试了顺铂敏感性,发现 PDO4 和 PDO5 对顺铂具有内在耐药性。令人振奋的是, LDHA 抑制剂 显著促进了顺铂对 PDO4 和 PDO5 的杀伤作用。另外在小鼠模型中, LDHA 抑制剂与顺铂或 IR 联合使用也显著抑制了肿瘤生长,并延长了小鼠的生存期。
研究小组最后进行了临床相关性研究,他们发现 LDHA 和 NBS1 K388 乳酸化在多种癌症中显著上调,且与含铂新辅助化疗耐药性相关。免疫组化分析显示,新辅助化疗耐药肿瘤中 LDHA 和 NBS1 K388 乳酸化水平增加,且两者呈正相关。高水平 LDHA 和 NBS1 K388 乳酸化的患者总体生存率较低。
总而言之,这项研究揭示了 NBS1 K388 乳酸化在肿瘤放化疗抵抗中的重要作用,并为乳酸代谢抑制作为癌症治疗策略提供了新的视角。
教授介绍
张常华 教授,中山大学附属第七医院副院长,中山大学医学院外科教研室主任。张常华教授课题组专注于胃肠肿瘤微创外科治疗、个体化靶向治疗以及家族性遗传性胃肠肿瘤的诊治研究。研究重点包括肿瘤浸润和转移的信号通路、胃癌治疗新靶点、免疫治疗、类器官、以及人工智能在胃肠肿瘤诊治中的应用。此外,课题组还从临床营养的角度进行基础研究。
参考文献
Chen H et al. “NBS1 lactylation is required for efficient DNA repair andchemotherapy resistance.” Nature , 10.1038/s41586-024-07620-9. 3 July.2024, doi: 10.1038/s41586-024-07620-9
链接:http://www.lewenyixue.com/2024/07/12/Nature%20%7C%20%E4%B8%AD%E5%B1%B1%E5%A4%A7%E5%AD%A6%E5%BC%A0%E5%B8%B8%E5%8D%8E%EF%BC%9A%E4%BB%A3%E8%B0%A2%E2%80%9C/









赶快来坐沙发