冷肿瘤逆转热肿瘤! 联用方案拯救癌症「免疫荒漠」, 疾病控制率最高60%!
前些日子,我们报道了一项超神的研究:无需手术及放化疗,仅凭免疫单药就让所有参与治疗的局部晚期错配修复缺陷(dMMR)直肠癌患者达到完全缓解,并且超过2年没有复发。十分震撼人心!
实际上,微卫星不稳定性高(MSI-H)/dMMR肠癌一直是免疫治疗的宠儿,但遗憾的是,他在所有肠癌中仅占比5%,而要说起剩下的,占比95%的微卫星稳定/错配修复熟练(MSS/pMMR)患者,那就要用“一线天堂,一线地狱”来形容了。(ps:通常情况下,MSI-H和dMMR、MSS和pMMR临床意义相同,有些研究可能会选其中之一进行检测)
在KEYNOTE-016研究中,dMMR肠癌患者接受大名鼎鼎的“K药”帕博利珠单抗的客观缓解率为40%,而pMMR肠癌患为0。是的,你没有看错,几乎完全无效。
如何让MSS/pMMR肠癌由“冷”变“热”,大幅提高免疫治疗获益是当下研究的痛点与难点。而近期,Nature Medicine上的一篇文章告诉我们,新兴的双免疫治疗有望打破这一僵局。
打好结构基础
勇往虎山行
早些年,研究者们其实并不是没有尝试过双免,度伐利尤单抗联合tremelimumab、纳武利尤单抗联合伊匹木单抗两大王牌双免组合都曾怀着雄心壮志,试图攻克MSS型肠癌,但结果令人失望,前者的客观缓解率是1/119,后者为1/23(CheckMate-142研究)。
那么,同样是PD-(L)1抗体与CTLA-4抗体的组合,研究者们为什么会认为Balstilimab联合Botensilimab有希望取得与之不同的结果呢?信心还是来源于药物结构设计。
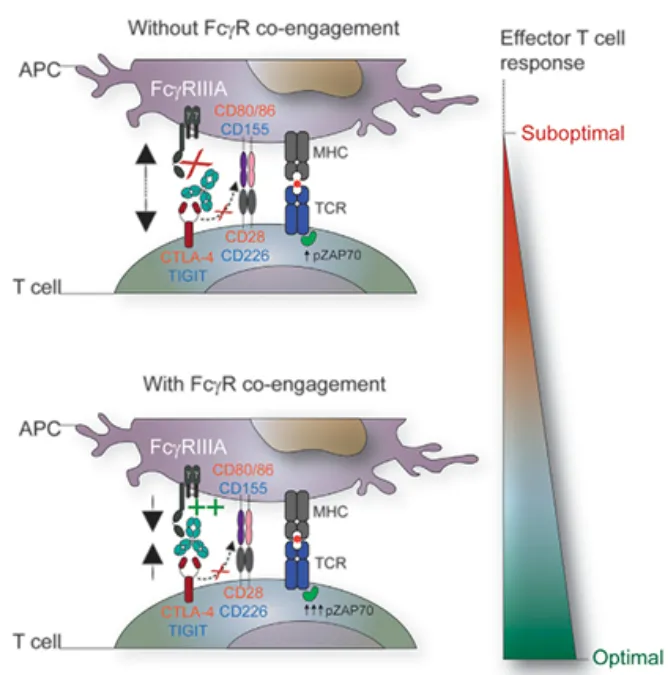
Botensilimab作为一种新型多功能Fc增强型抗CTLA-4抗体,其出生就怀着“克服传统免疫检查点阻断的局限性”的使命。除了阻断CTLA-4之外,Botensilimab还可以通过加强APC和T细胞的共同参与来促进优化的T细胞启动、活化和记忆形成。并通过抗体依赖性细胞毒性和吞噬机制促进肿瘤内Treg耗竭。
这些特征使其与已获批的CTLA-4抗体区分开来,Botensilimab有可能通过激活先天和适应性免疫系统,将益处扩展到“冷”或免疫检查点阻断难治性肿瘤。
OS超20个月
分析揭示肝转移患者治疗差距
该研究的入组人群预后极差,为既往接受过大量治疗后进展的复发难治性MSS型转移性结直肠癌患者,其中101名患者可评估疗效。
在本研究中Balstilimab联合Botensilimab显示出卓越的抗肿瘤活性。接受治疗的患者客观缓解率(ORR)为17%,其中有1例患者达到了完全缓解,疾病控制率(DCR)高达61%。并且应答的患者展现出持续缓解的特征,截至目前,中位缓解持续时间仍未达到。在总人群中,中位无进展生存期(PFS)为3.5个月(95% CI,2.7-4.1 个月),总生存期(OS)长达20.9个月(95% CI,10.6个月-NR),12个月OS率为60%。对于复发难治性MSS患者而言,该数据极具前景。
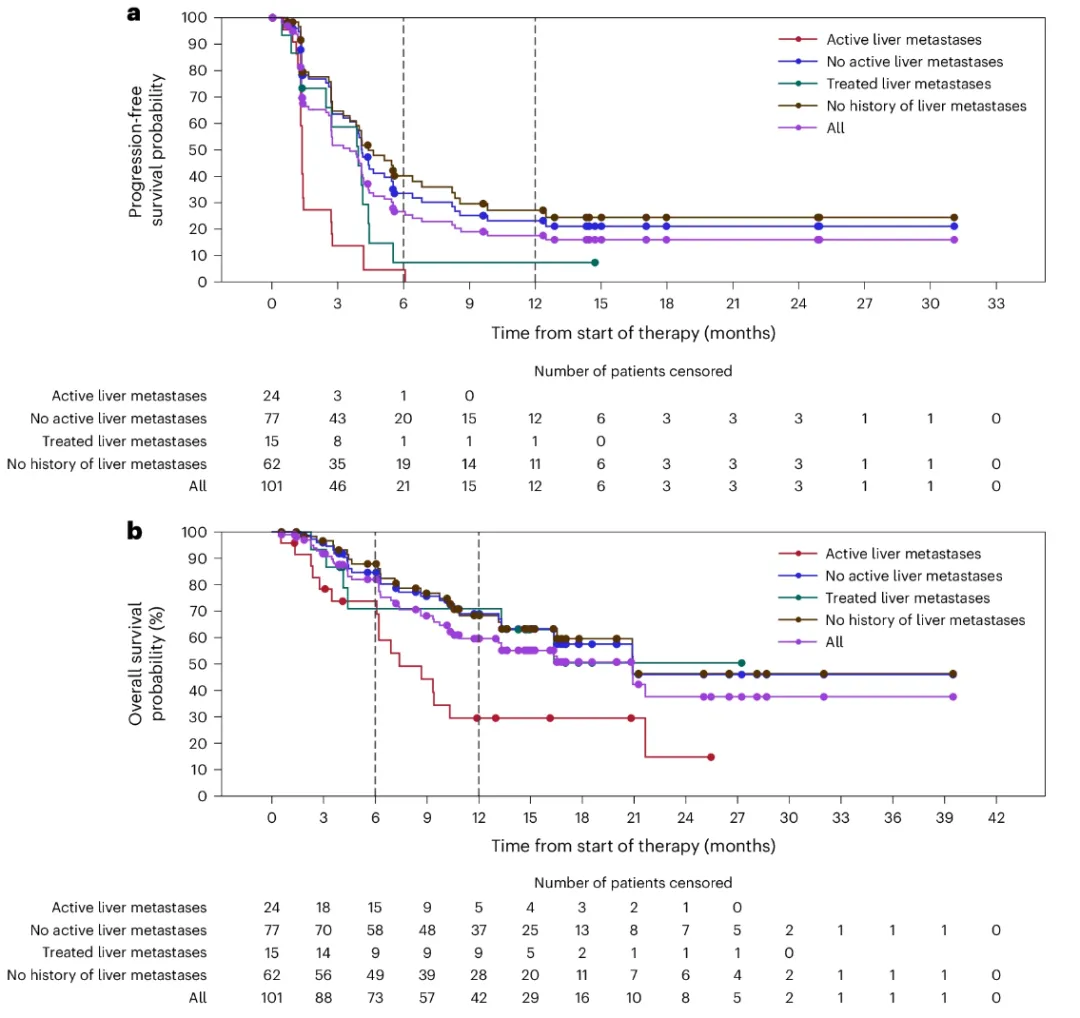
不过,这种获益似乎仅集中在未出现肝转移及肝转移切除或消融后未复发(NLM)的患者中,进一步分析显示:
● NLM患者的ORR为22%,DCR为73%,中位PFS为4.1个月(95% CI,3.3-5.5个月)。中位OS为20.9个月(95% CI,16.4个月-NR),12个月OS率高达69%。
● 而具有活动性肝转移病灶(LM)的患者,很遗憾,ORR仍旧为0%。DCR为25%,中位PFS为1.4个月(95% CI,1.3-1.4 个月),中位OS为7.4个月(95% CI,6.1-10.3个月)。
这一数据与其他临床报告一致,并且最近的研究表明,肝脏具有免疫抑制环境,这可能使得LM对免疫检查点抑制剂产生特异性耐药性。总之,这转移部位可能是免疫治疗效果的重要预测生物标志物。
按肝脏受累情况划分的肿瘤缓解程度
按肝脏受累情况划分的PFS及OS
再来看看安全性方面,89%的患者出现了任何级别的治疗相关不良反应(TRAE),多为1~2级,最常见的是疲劳(35%;其中1%为3级TRAE,无4级TRAE)、腹泻(32%;5%为3级,无4级)和发热(24%;3%为3级,无4级)。
总之,在该研究中,Balstilimab联合Botensilimab在接受过大量治疗的复发难治性MSS型结直肠癌中显示出令人鼓舞的抗肿瘤活性,并且缓解持久,同时具有可管可控的安全性。这一结果使得医学界对该双免组合充满信心,目前随机II期研究正在进行中,咚咚将会持续跟进。
参考文献:
[1]. Bullock AJ, et al.Botensilimab plus balstilimab in relapsed/refractory microsatellite stable metastatic colorectal cancer: a phase 1 trial. Nat Med. 2024 Jun 13.
[2]. Waight JD, et al. Selective FcγR Co-engagement on APCs Modulates the Activity of Therapeutic Antibodies Targeting T Cell Antigens. Cancer Cell. 2018 Jun 11;33(6):1033-1047.e5.
链接:http://www.lewenyixue.com/2024/07/10/%E5%86%B7%E8%82%BF%E7%98%A4%E9%80%86%E8%BD%AC%E7%83%AD%E8%82%BF%E7%98%A4%21%20%E8%81%94%E7%94%A8%E6%96%B9%E6%A1%88%E6%8B%AF%E6%95%91%E7%99%8C%E7%97%87%E3%80%8C%E5%85%8D/






赶快来坐沙发