“双艾”治疗进展期黏膜黑色素瘤疗效显著,TMB-H及高TCR多样性或与更优的获益相关
前言
近日,南京大学医学院附属鼓楼医院邹征云教授团队发表了一项关于卡瑞利珠单抗与阿帕替尼(简称“双艾”方案)联合应用于进展期黏膜黑色素瘤(MM)治疗的临床研究,此项研究刊登在《Journal for ImmunoTherapy of Cancer》上(IF=10.3)[1]。
研究发现“双艾”方案用于进展期黏膜黑色素瘤疗效可靠、安全性可控,研究团队通过测序技术首次揭示了TMB-H(肿瘤突变负荷高)及高TCR(T细胞受体)多样性与黏膜黑色素瘤免疫治疗疗效之间的相关性,这一发现为优化进展期黏膜黑色素瘤患者的治疗策略提供了更多的选择。
研究发表于Journal for ImmunoTherapy of Cancer
初治/经治MM均能从“双艾”方案获益
前路漫漫
MM患者从免疫单药治疗中获益极为有限
黏膜黑色素瘤是一类起源于呼吸道、消化道和泌尿生殖道等黏膜上皮的黑色素瘤,其在欧美发病率相对较低,但在我国却呈现出较高的发病率,占据黑色素瘤亚型的第二位,占比高达22.6%[2,3]。相较于皮肤黑色素瘤,MM患者的预后往往更为严峻[4,5],特别是转移性MM患者的5年生存率仅为16%[5]。
在既往的免疫治疗研究中,如KEYNOTE-001、002、006研究的事后分析提示,采用帕博利珠单抗治疗的MM患者客观缓解率(ORR)仅为19%,中位无进展生存期(PFS)和总生存期(OS)也相对较短[6]。而针对中国患者的KEYNOTE-151研究同样表明,帕博利珠单抗在进展期MM患者中的疗效有限,ORR仅为13.3%[7,8]。此外,POLARIS-01研究中的特瑞普利单抗在中国局部进展期或转移性MM患者中的ORR为0.0%[9],这与最早获益于免疫检查点抑制剂治疗的皮肤型黑色素瘤的疗效形成鲜明对比。
上下求索
“双艾”方案提交优异答卷
面对这一挑战,抗血管生成药物因其能够促进血管正常化、逆转免疫抑制性肿瘤微环境而备受关注。其中,阿帕替尼作为一种靶向血管内皮生长因子受体2的小分子酪氨酸激酶抑制剂,已在多项研究中展示出抗肿瘤活性[10-13]。免疫检查点抑制剂(ICI)与抗血管生成药物的联合治疗方案被广泛探索[14-16]。
邹征云教授团队的这项研究不仅深入探讨了“双艾”方案在进展期MM患者中的疗效和安全性,还进一步挖掘了潜在的预测性生物标志物,为未来的治疗策略提供了重要的参考依据。
1
研究简介
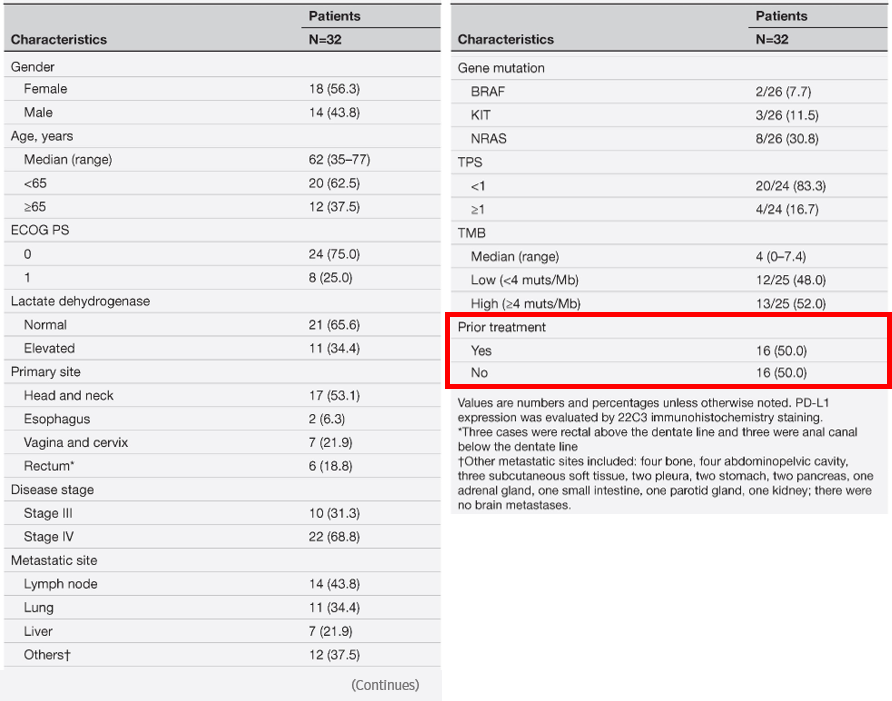
本研究是一项单臂、II期临床试验,2019年4月至2022年6月共入组32例进展期黏膜黑色素瘤患者,接受卡瑞利珠单抗联合阿帕替尼治疗。在这些患者中,14例为男性,18例为女性。中位年龄为62岁(范围:35-77岁)。50.0%(16/32)的患者有既往治疗史,包括术后辅助化疗、姑息化疗、放疗和抗血管生成治疗。原发灶部位:头颈部17例,食管2例,阴道及宫颈7例,直肠6例。淋巴结转移14例,肺转移11例,肝转移7例(表1)。
表1.患者基线特征
2
临床疗效
截至2022年10月11日,28例可疗评患者中位随访时间为18.07个月(IQR:3.75-36.40)。根据RECIST v.1.1确认的ORR为42.9%(95% CI:24.5%-62.8%);疾病控制率(DCR)为82.1%,包括1例(3.6%) 确认完全缓解(CR)的患者、11例(39.3%)确认部分缓解(PR)的患者和11例(39.3%)疾病稳定(SD)的患者。
图1.瀑布图(左)和蜘蛛图(右)
图2. 泳道图(左)和最佳缓解情况汇总(右)
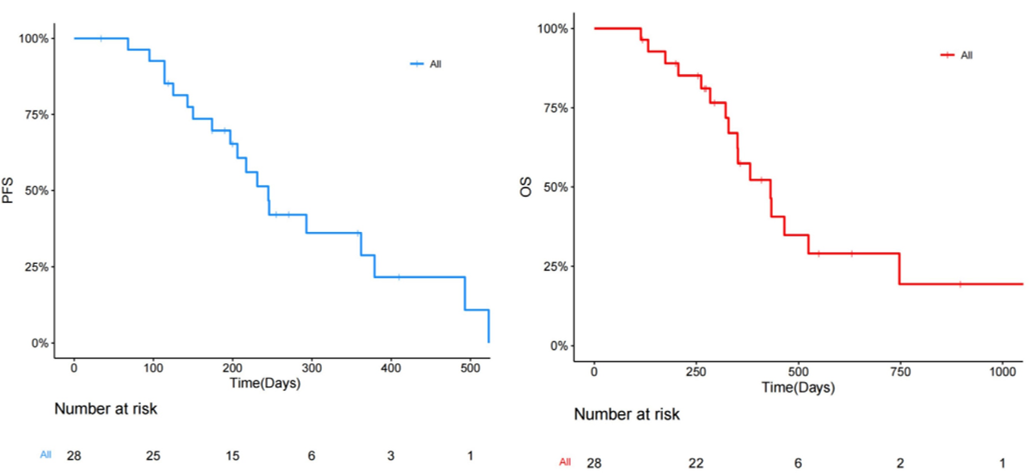
中位PFS和OS分别为8.05个月(95% CI:6.05-NR)和14.19个月(95% CI:11.53-NR)。既往接受过治疗的患者中位PFS为6.47个月(95% CI:4.7-NR),未接受过治疗的患者中位PFS为11.89个月(95% CI:8.08-NR)。
图3.PFS(左)和OS(右)的K-M图
图4. 既往接受过治疗和未接受过治疗患者中PFS的K-M曲线
生物标志物探索:
首次揭示TMB-H及高TCR多样性与MM免疫治疗疗效之间的相关性
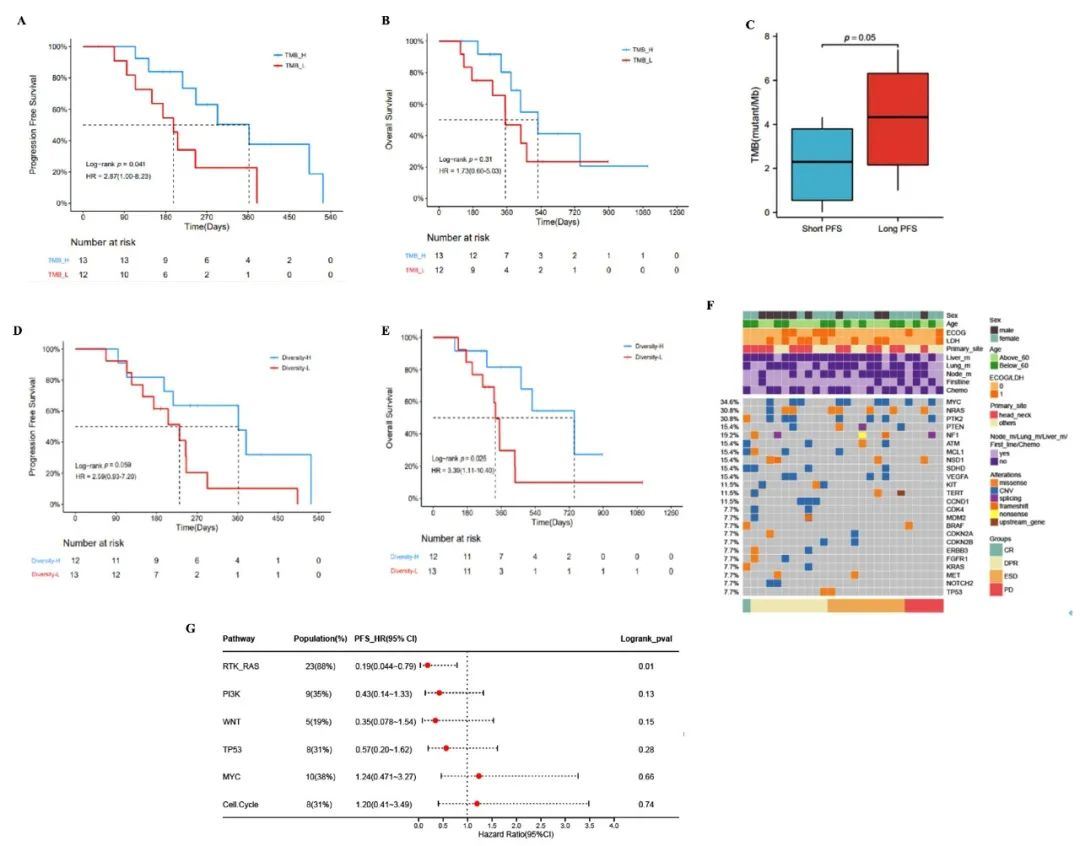
本研究从PD-L1表达水平、基因变异状态及肿瘤突变负荷(TMB)等多个维度探索了卡瑞利珠单抗联合阿帕替尼治疗疗效相关的生物标志物。结果提示,PD-L1表达与临床获益(ORR、PFS和OS)无显著相关性(可能受限于样本量有限)。
通过分析不同TMB阈值与临床获益之间的关联性发现,TMB越高,免疫联合治疗的ORR和PFS越高。以4个突变/Mb为阈值时,TMB-H患者的PFS显著更长(p=0.041),而OS未见显著差异(图5A、B)。研究将PFS<6个月定义为短PFS,PFS≥6个月定义为长PFS。长PFS患者的TMB显著高于短PFS患者(平均TMB:4.3 vs 2.2个突变/Mb;p=0.05)(图5C)。
此外,研究采集患者基线外周血进行TCR测序以探讨TCR库与疗效之间的关系,结果显示高TCR多样性患者PFS(p=0.059)和OS(p=0.025)均显示更优(图5D、E)。基因层面,全外显子测序和生物信息学分析显示,携带RTK/RAS通路变异的患者PFS显著延长(p=0.010)(图5F、G)。
图5. TMB、TCR多样性和RTK/RAS通路与反应相关
邹征云教授
点评研究亮点
- 本项研究首次在进展期黏膜黑色素瘤患者中探索了卡瑞利珠单抗与阿帕替尼的联合应用,研究提示:进展期MM患者无论是初诊还是经治,“双艾”方案均展现出了良好的抗肿瘤活性和可控的安全性。
- 通过NGS和TCR测序技术进行生物标志物探索进一步发现,TMB-H及高TCR多样性与黏膜黑色素瘤免疫治疗疗效之间存在相关性,可能为进一步优化临床治疗决策提供参考。
研究案例分享
案例分享1
基本情况:
丁某,老年女性
阴道黏膜恶性黑色素瘤IV期(肺、胸腔、骨)
既往术后接受过替莫唑胺+顺铂+恩度治疗,放疗(外照射+后装)
入组治疗经过:
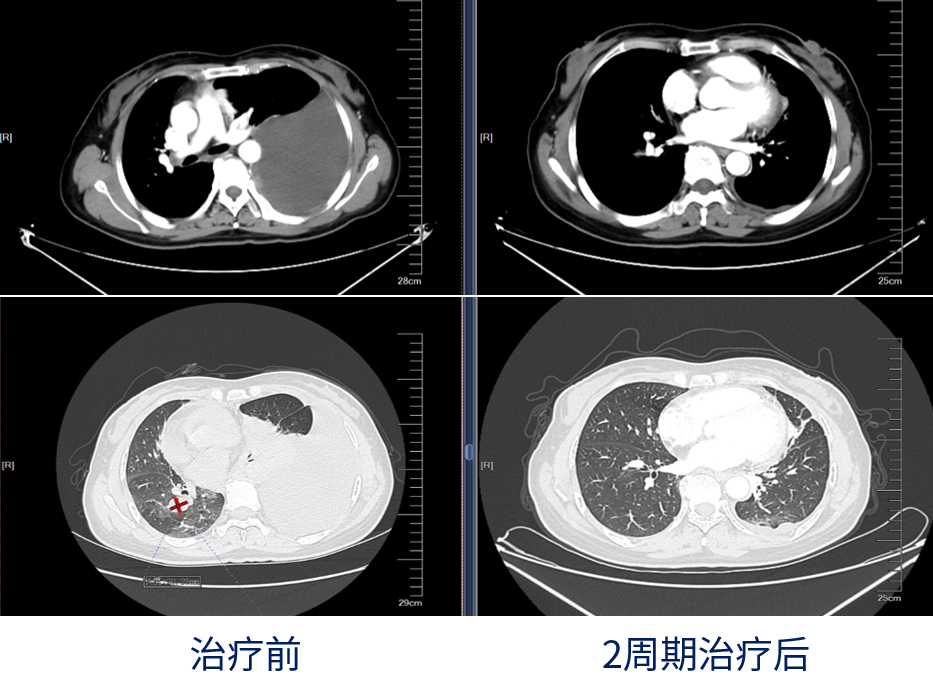
2020-08因胸闷气喘复查评估发现肺、胸腔、骨转移,2020-08-18入组
2020-08-19起卡瑞利珠单抗+阿帕替尼治疗
第1次治疗后数天,胸闷气喘明显好转(未引流胸水)
2周期治疗后,无胸闷不适,疗效评价PR
案例分享2
基本情况:
王某,老年男性
鼻腔黏膜恶性黑色素瘤术后复发
入组治疗经过:
鼻出血伴鼻塞起病,2019-10-23入组
2019-10-24起卡瑞利珠单抗+阿帕替尼治疗
2019-10-30鼻出血好转
2019-11-01鼻腔通气
2019-12-06鼻腔内窥镜未见新生物
2周期后,疗效评价PR
研究进展
截至发稿前,2022年6月入组的032号受试者刚刚完成为期2年的“双艾”治疗,仍在持续获益中。
拓展阅读:
TMB-H及高TCR多样性介绍
1
TMB-H(高肿瘤突变负荷)
TMB-H是指肿瘤基因组内存在的体细胞突变位点数量较高,能够间接反映肿瘤产生新生抗原的能力。具体地,TMB被定义为肿瘤基因组区域中每兆碱基(Mb)发生的碱基替换突变和插入缺失突变的数量总和,单位为muts/Mb²。
高肿瘤突变负荷(TMB-H)与实体瘤患者接受免疫治疗后呈现持续缓解有相关性。2020年6月,基于2期的KEYNOTE-158研究结果,FDA批准帕博利珠单抗单药治疗用于不可切除或转移性的,具有高组织肿瘤突变负荷(TMB-H,定义为TMB≥10 Muts/Mb)的成人和儿童实体瘤患者(既往治疗后疾病进展且没有更佳替代疗法)[17]。
2
高TCR多样性(T细胞受体多样性)
T细胞是适应性免疫系统的组成部分,其反应由独特的T细胞受体(TCR)介导,这些受体可识别来自各种生物环境的特定抗原。因此,分析T细胞库可以更好地了解免疫反应和癌症等疾病[18]。
高TCR多样性是指T细胞受体(TCR)在个体中的多样性,它使免疫系统能够识别并对外来物质(如病原体、疫苗和移植器官等)作出反应。TCR的多样性主要由四种TCR基因(TCRα、TCRβ、TCRδ和TRCϒ)产生的基因组重排所形成。
高TCR多样性赋予个体几乎是无限的抗原识别和应答能力,保证个体在多变环境中能和外来抗原发生有效的免疫应答。
研究者介绍
邹征云 教授
- 南京鼓楼医院肿瘤中心 主任医师
- 南京大学博士研究生导师
- 南京鼓楼医院江北院区 副院长
- 江苏省抗癌协会肿瘤标记委员会 副主任委员
- 江苏省免疫学会肿瘤免疫专业委员会 副主任委员
- 江苏省研究型医院学会生物治疗学专委会 副主任委员 & 秘书长
- 江苏省医学会肿瘤学分会黑色素瘤学组 组长
- 中国中西医结合学会皮肤性病委员会皮肤肿瘤学组 副组长
- 国家癌症中心、国家肿瘤质控中心黑色素瘤质控专家委员会 委员
- 中国研究型医院学会生物治疗学专委会 常务委员
- 江苏省六大高峰人才
- 国家自然科学基金评审专家
- 专业方向:恶性肿瘤精准免疫治疗;恶性黑色素瘤的基础与临床研究。
赵莲君 医师
- 南京鼓楼医院 肿瘤中心,主治医师,南京大学在读博士
- 江苏省研究型医院学会生物治疗学专业委员会 委员
- 以第一作者在JITC等期刊发表SCI论文及中文核心多篇
参考文献(上下滑动查看):
[1] Zhao L, Ren Y, Zhang G, et al. Single-arm study of camrelizumab plus apatinib for patients with advanced mucosal melanoma. J Immunother Cancer. 2024;12(6):e008611. Published 2024 Jun 21. doi:10.1136/jitc-2023-008611
[2] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China. CA A Cancer J Clinicians 2016;66:115–32.
[3] Chi Z, Li S, Sheng X, et al. Clinical presentation, histology, and prognoses of malignant melanoma in ethnic Chinese: a study of 522 consecutive cases. BMC Cancer 2011;11:85.
[4] Shoushtari AN, Bluth MJ, Goldman DA, et al. Clinical features and response to systemic therapy in a historical cohort of advanced or unresectable mucosal melanoma. Melanoma Res 2017;27:57–64.
[5] Chang AE, Karnell LH, Menck HR. The National cancer data base report on cutaneous and noncutaneous melanoma. Cancer 1998;83:1664–78.
[6] Hamid O, Robert C, Ribas A, et al. Antitumour activity of pembrolizumab in advanced mucosal melanoma: a post-¬hoc analysis of KEYNOTE-¬001, 002, 006. Br J Cancer 2018;119:670–4.
[7] Si L, Zhang X, Shu Y, et al. Pembrolizumab in Chinese patients with advanced melanoma: 3-¬year follow-¬up of the KEYNOTE-¬151 study. Front Immunol 2022;13.
[8] Si L, Zhang X, Shu Y, et al. A phase IB study of pembrolizumab as second-¬line therapy for Chinese patients with advanced or metastatic melanoma (KEYNOTE-¬151). Transl Oncol 2019;12:828–35.
[9] Tang B, Chi Z, Chen Y, et al. Safety, efficacy, and biomarker analysis of toripalimab in previously treated advanced melanoma: results of the POLARIS-¬01 multicenter phase II trial. Clin Cancer Res 2020;26:4250–9.
[10] Wang X, Wu X, Yang Y, et al. Apatinib combined with camrelizumab in advanced acral melanoma patients: an open-¬label, single-¬arm phase 2 trial. Eur J Cancer 2023;182:57–65. [11] Yang L, Zhu H, Luo P, et al. Apatinib mesylate tablet in the treatment of advanced malignant melanoma. Onco Targets Ther 2018;11:5333–8.
[12] Liu Z-¬J-¬L, Zhou Y-¬J, Ding R-¬L, et al. In vitro and in vivo apatinib inhibits vasculogenic mimicry in melanoma MUM-¬2B cells. PLoS One 2018;13:e0200845.
[13] Zhang J, Liu P, Zhang Z, et al. Apatinib-¬loaded nanoparticles inhibit tumor growth and angiogenesis in a model of melanoma. Biochem Biophys Res Commun 2020;521:296–302. [14] Sheng X, Yan X, Chi Z, et al. Axitinib in combination with toripalimab, a humanized immunoglobulin G(4) monoclonal antibody against programmed cell death-¬1, in patients with metastatic mucosal melanoma: an open-¬label phase IB trial. J Clin Oncol 2019;37:2987–99.
[15] Li S, Wu X, Yan X, et al. Toripalimab plus Axitinib in patients with metastatic mucosal melanoma: 3-¬year survival update and biomarker analysis. J Immunother Cancer 2022;10:e004036.
[16] Mao L, Fang M, Chen Y, et al. Atezolizumab plus bevacizumab in patients with unresectable or metastatic mucosal melanoma: a multicenter, open-¬label, single-¬arm phase II study. Clin Cancer Res 2022;28:4642–8.
[17]https://www.fda.gov/drugs/drug-approvals-and-databases/fda-approves-pembrolizumab-adults-and-children-tmb-h-solid-tumors
[18]Frank ML, Lu K, Erdogan C, Han Y, Hu J, Wang T, Heymach JV, Zhang J, Reuben A. T-Cell Receptor Repertoire Sequencing in the Era of Cancer Immunotherapy. Clin Cancer Res. 2023 Mar 14;29(6):994-1008. doi: 10.1158/1078-0432.CCR-22-2469. PMID: 36413126; PMCID: PMC10011887.
* 此文仅用于向医学人士提供科学信息,不代表本平台观点
链接:http://www.lewenyixue.com/2024/07/05/%E2%80%9C%E5%8F%8C%E8%89%BE%E2%80%9D%E6%B2%BB%E7%96%97%E8%BF%9B%E5%B1%95%E6%9C%9F%E9%BB%8F%E8%86%9C%E9%BB%91%E8%89%B2%E7%B4%A0%E7%98%A4%E7%96%97%E6%95%88%E6%98%BE%E8%91%97%EF%BC%8C/













赶快来坐沙发