未来的早期癌症检测方法:合成生物标志物
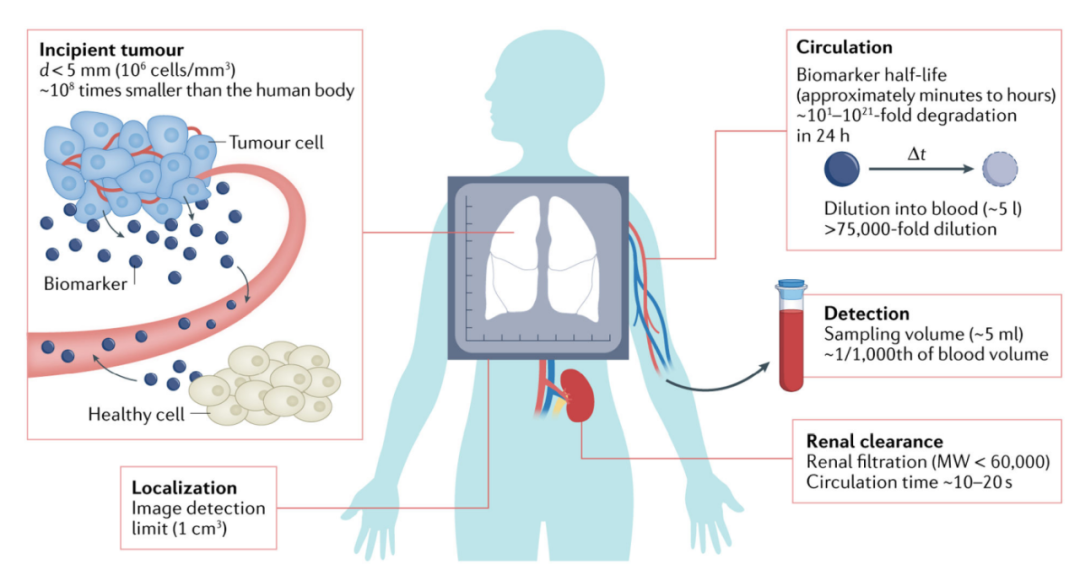
在癌症仍处于局部状态的早期检测可改善大多数癌症类型患者对医疗干预的反应。宫颈细胞学等筛查工具在降低死亡率方面的成功,引发了人们对早期检测新方法的极大兴趣( 例如,使用非侵入性血液或生物流体生物标记物 )。然而,从早期病变中产生的生物标志物受到基本的生物和运输障碍的限制,例如循环时间短和血液中的稀释,需要高灵敏度的方法来检测非常低的信号水平。此外,个体生物标记物通常缺乏特异性,它们在非癌性条件下可能会升高,或者在多种癌症中存在,这就需要识别多种分析物组合以评估疾病。
这些经验教训为基于生物工程传感器( 如分子探针或基因编码载体 )设计的新兴诊断提供了依据,这些传感器利用了早期肿瘤或其前体的失调特征,产生一个放大的信号,这些外源性传感器利用肿瘤依赖性激活机制,如酶放大,来驱动合成生物标记物的产生和放大。癌症也可以通过成像系统进行检测,这些系统可能具有合成生物标记物方法的基本特征,例如报告基因成像。这些新兴的技术推动了早期癌症检测的发展,合成生物标志物可能成为未来的早期癌症检测方法。
早期癌症检测对于持续脱落的生物标记物,如蛋白质,患者肿瘤的生物标记物并非普遍呈阳性,即使对于相同肿瘤类型的细胞,分泌率也可能变化多达四个数量级。此外,由死亡细胞释放的生物标记物只会脱落一次,它们的检测与健康组织的背景脱落很容易混淆。例如,细胞游离DNA( cfDNA )是从全身非癌细胞中释放出来的,这使得恶性细胞与正常细胞的体细胞突变比例或变异等位基因频率( VAF )在低肿瘤负荷下越来越难以检测。
通过治疗追踪非小细胞肺癌进展研究的分析预测,1、10或100cm3的原发肿瘤负荷将导致平均血浆VAF分别为0.006%、0.1%或1.3%。对于典型的4毫升血浆,据估计,每管平均只有6个分子携带相应的体细胞突变。进一步加剧技术挑战的是,生物标记物被大量血液稀释,导致在循环中被降解或清除,例如,ctDNA在血液中的循环半衰期不到1.5小时。
虽然,基于数学模型预测和基因组时间线研究一致估计了至少十年的早期癌症检测机会窗口。但是,快速生长和高度侵袭性的癌症,可能会在几个月到几年的相对狭窄窗口内迅速进展,并与较差的临床结果相关。例如三阴性乳腺癌和高度浆液性卵巢癌( HGSOC ),其肿瘤具有BRCA1或BRCA2突变,或同源重组缺陷。合成生物标志物研究领域的进展旨在应对这些挑战,主要方法是利用基于活性或基因编码的机制进行早期检测。
用外源性药物全身给药来评估体内生物功能有着悠久的临床历史。 基于活性的合成生物标记物就基于这种模式,包括由肿瘤或其微环境中的酶激活的传感器和小分子探针,以提供肿瘤生物标记物的分子放大机制。
蛋白酶激活的合成生物标记物
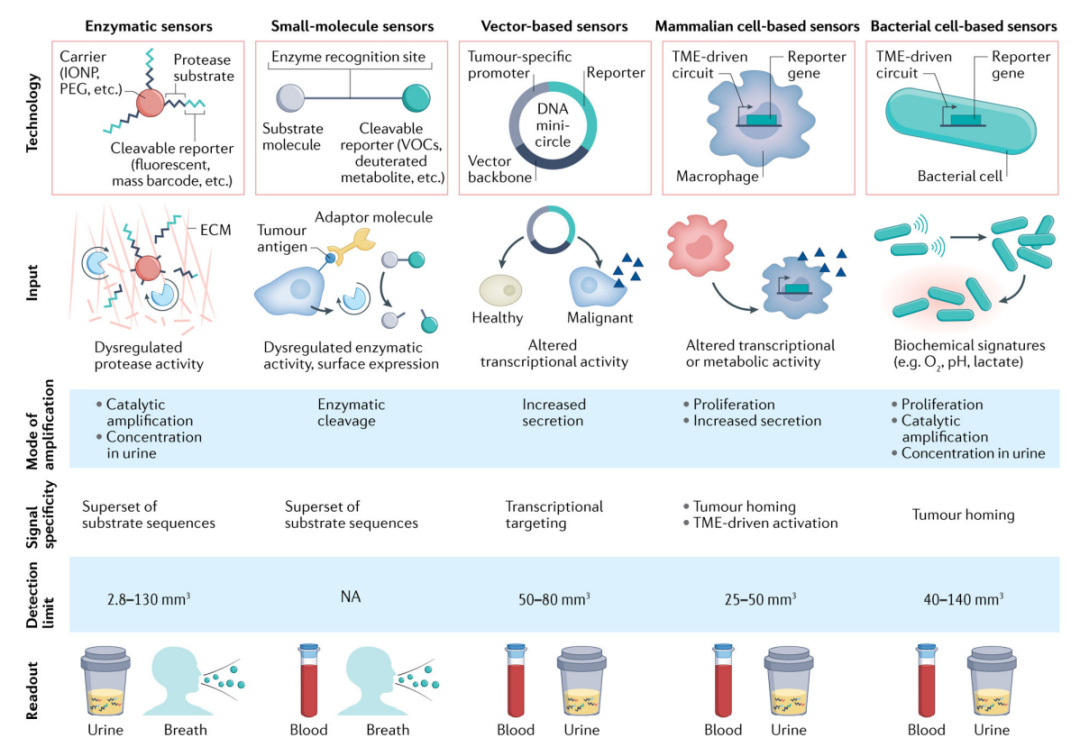
蛋白酶激活的合成生物标记物包括结合到惰性载体表面的肽底物,该载体在被肿瘤蛋白酶酶切后释放报告物到血液或尿液中进行检测。除了分子信号放大之外,达到早期检测所需检测限( LOD )的另一个关键策略是利用人体生理学特征来增加生物流体中的合成生物标记物浓度。一种方法是通过选择流体动力学半径大于肾小球滤过屏障( ~5nm )的载体,利用肾脏的大小过滤,以防止表面结合肽被清除到尿液中。
另一个关键策略是加强被动递送到肿瘤部位。例如使用聚乙二醇( PEG )聚合物加氧化铁纳米颗粒( IONPs )具有更高的被动扩散速率,可以增加对肿瘤的输送。另一种方法是利用肿瘤穿透配体使传感器功能化,这些配体参与到肿瘤微环境的活跃运输途径。
蛋白酶是一种混合酶,能够切割多种底物序列,这限制了单个传感器的检测特异性。因此,另一个关键设计原则是设计一个多传感器库,通过特征分析检测癌症。这种方法要求传感器库中的每个合成生物标记物都用独特的分子进行标记。
小分子探针
鉴于越来越多的肿瘤特异性抗原、细胞表面标记物和代谢途径可作为小分子的靶点,一些研究重点放在工程化分子探针,以生成用于癌症检测的合成生物标记物。
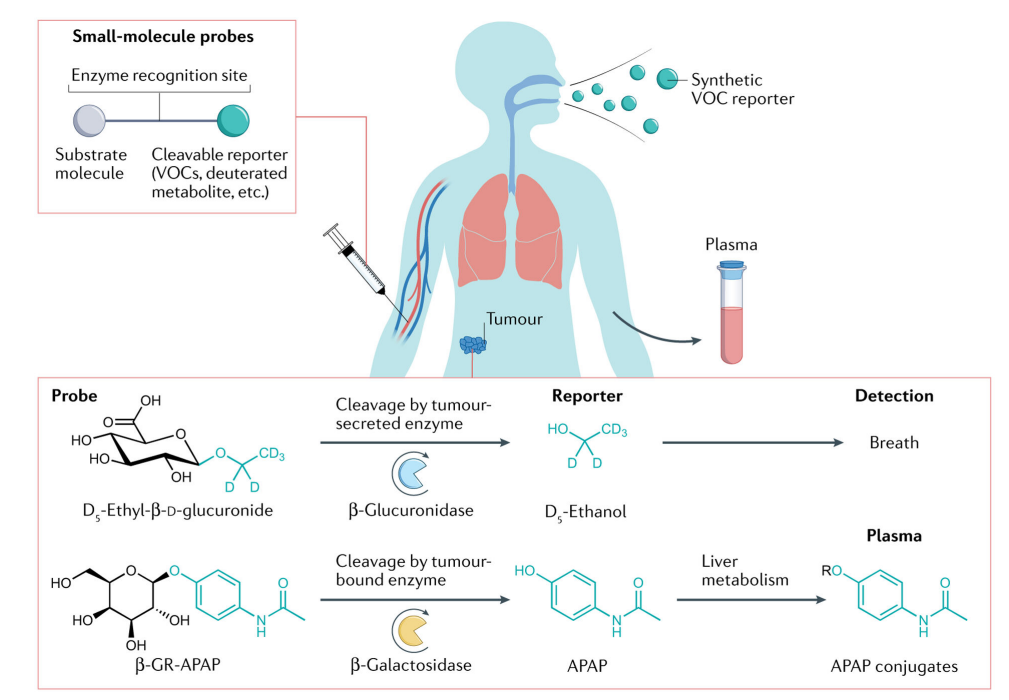
30多年来,稳定同位素标记的小分子被广泛用作研究实验室的诊断探针。稳定同位素标记的优点包括:对患者没有辐射风险,与未经修饰的对应物相比代谢没有差别,以及高信噪比。FDA已经批准了几种同位素标记探针,包括 13 C -methacetin和 13 C -cholate,它们分别测量肝细胞色素P450活性和肝分流,用于测量肝纤维化背景下的肝功能障碍,肝纤维化是肝细胞癌的一个重要风险因素。
患者呼吸样本中存在的天然挥发性有机化合物( VOCs )也已用于癌症诊断。Lang等人使用了一种同位素标记的合成VOC,称为“ D 5 乙基-β-D-葡糖苷酸”( EtGlu ),它是乙醇的氘化代谢物。静脉注射后,EtGlu通过β-葡萄糖醛酸酶( 一种由实体瘤分泌的胞外酶 )酶转化为 D 5 乙醇,然后通过气相色谱结合高分辨率质谱从呼吸中检测。
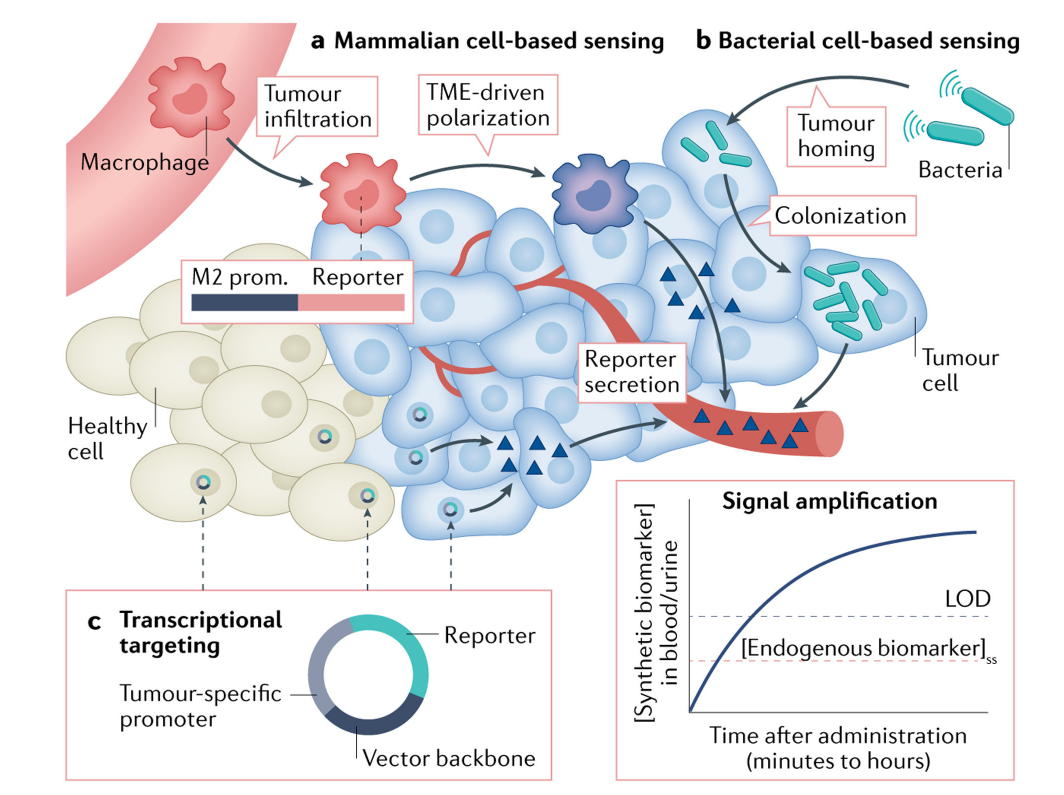
哺乳动物合成生物学的进步正在推动生物传感的发展。 除了基于活性的探针外,基因编码的结构还形成了另一组主要策略,使用工程组件或细胞来放大合成生物标记物的释放。 这些方法侧重于驱动肿瘤微环境中的常驻细胞或浸润细胞产生或分泌生物正交报告物的策略。 这些方法的主要优点是能够将合成生物标记物的产生转录到特定表型的细胞,从而潜在地减少健康组织中由背景产生引起的假阳性数量。 目前,有三大类用于产生合成生物标记物的基因编码系统,包括基于载体的系统、基于哺乳动物细胞的系统和基于细菌细胞的系统。
基于载体的合成生物标记物
基于载体的系统依赖于两个关键设计组件:一个组织选择性或癌症选择性启动子来驱动转录,一个合成生物标记物被设计成分泌到血液或尿液中用于检测。组织选择性启动子提供了第一水平的特异性,例如正常沉默的人类端粒酶逆转录酶( TERT )的启动子,它编码端粒酶,端粒酶在癌细胞中经常被激活以实现增殖永生,这是癌症的标志之一。由于TERT在约90%的人类癌症中高水平表达,但在几乎所有的体细胞中都被沉默,因此TERT启动子已被用于驱动多种肿瘤细胞中的基因表达。
基于载体策略的第二个组成部分是作为合成生物标记物的分泌报告物,可以在血液或尿液中检测到。分泌型胚胎碱性磷酸酶( SEAP )是第一批被设计用于体内应用的报告物之一。SEAP是人类胎盘碱性磷酸酶的一种工程形式,在膜锚定结构域包含一个终止密码子,将其转化为一个截短但完全活跃的分泌型报告物。在异种移植肿瘤模型中,SEAP水平与肿瘤大小和细胞数量直接相关。另一个常用的报告物是荧光素酶。
基于哺乳动物细胞的合成生物标记物
最近过继细胞疗法的临床成功激发了工程化哺乳动物细胞作为活体生物传感器的尝试。细胞作为诊断载体的一个明显优势是,与分子探针相比,一些细胞能够定位并浸润癌症部位,而分子探针依赖于血管系统的被动扩散来积聚在肿瘤中,因此受到限制。
间充质干细胞( MSCs )是具有再生和免疫调节特性的成年多能干细胞,Liu等人使用小鼠模型证明了工程化MSC可用于检测血液中的癌症转移。首先,MSCs被设计成分泌人源化谷氨酸,静脉注射后,与无肿瘤小鼠相比,乳腺癌肺转移小鼠体内的工程化MSC持续时间更长,导致人源化Gluc的血液水平更高。然而,由于MSCs对炎症和损伤部位表现出趋化性,或自身可能参与癌症进展,因此需要更多的研究来了解这些潜在的局限性。
Aalipour等人进一步发展了基于细胞的诊断概念,使用工程化巨噬细胞作为活细胞传感器。研究发现,肿瘤相关巨噬细胞M2型重编程导致精氨酸酶1( 由ARG1编码 )水平发生显著变化,而在实体瘤中过继转移的巨噬细胞可将精氨酸酶1上调多达200倍。基于这一发现,他们使用ARG1启动子在巨噬细胞M2极化时驱动谷氨酸的产生。这项研究为细胞免疫诊断的概念奠定了基础,考虑到许多其他免疫细胞在肿瘤微环境中同样调节代谢基因的表达,这种方法也可以扩展到T细胞、B细胞和自然杀伤细胞。
基于细菌的合成生物标记物
某些类型的细菌渗透并选择性地在肿瘤中生长,这归因于抑制免疫监视和实体瘤核心内坏死细胞释放的营养素水平增加。这促使人们使用工程化肿瘤靶向细菌作为癌症检测的可编程载体。
Panteli等人对一种肠道沙门氏菌减毒菌株进行了基因改造,其毒性比野生型菌株低10000倍,可以释放出作为荧光生物标记物或“荧光标记物”的ZsGreen。在对荷瘤小鼠进行静脉给药后,血清中的荧光标记物水平取决于肿瘤质量,可通过数学建模预测其检测肿瘤的能力。
细菌用于早期癌症检测仍需要应对几个挑战。尽管包括梭菌、大肠杆菌和沙门氏菌在内的工程菌株已被证明对动物和人类无致病性,但细菌成分的固有毒性和恢复毒性的可能性带来了安全问题。此外,目前还不清楚是否所有缺乏坏死核心的肿瘤类型和新生病变都能被系统输送的细菌定植。
合成生物学的进步可以提供这些挑战的解决方案,同时也为设计具有特定和受控行为的“智能”微生物提供了机会。例如,使用群体感应生物电路设计的细菌可用于细菌通信,以同步活动,并产生紧急行为,如在达到阈值种群密度后,定时释放治疗药物,以杀死肿瘤或促进系统性抗肿瘤免疫。应用于早期癌症检测领域,这些生物电路有可能通过降低健康组织的背景活性来增加特异性。在未来,这些基因可编程载体可能有潜力被开发成安全和定期摄入的食品( 例如酸奶 ),以便进行常规癌症筛查或癌症化学预防。
已有大量临床前研究报告表明,基于活性的合成生物标记物具有实现早期检测所需LOD的潜力。
在异种移植小鼠模型中,由IONPs与独特肽底物结合组成的基于活性的传感器能够识别LS174T大肠肿瘤,其体积比血清生物标记物CEA检测到的体积小60%。Kwon等人报道了一种基于活性分子的传感器,该传感器结合了肿瘤穿透肽,在原位卵巢癌模型中靶向并增加其对转移结节的传递,以进一步降低LOD。通过量化尿液中富集的合成生物标记物,他们报告了当中位结节直径小于2mm且平均总肿瘤负荷为36 mm3时,以近乎完美的精确度( AUROC为0.99 )检测肿瘤转移的能力。相比之下,只有当平均肿瘤负荷达到88 mm3时,人类附睾蛋白4( HE4 )血清生物标记物才能指示肿瘤转移。
关于基因编码的合成生物标记物的体内LOD研究也有报道。Aalipour等人的研究表明,过继转移的工程化巨噬细胞传感器检测到中等大小的CT26大肠肿瘤( 体积50–250 mm3 ),其敏感性和特异性为100%,在将其巨噬细胞传感器的性能与LS174T肿瘤分泌的血浆CEA或CT26肿瘤释放的cfDNA进行比较的基准研究中,他们报告了较低的LOD。CEA可检测到体积约136 mm3的肿瘤,而cfDNA可检测到体积大于1500 mm3的肿瘤。
由于该领域尚处于起步阶段,合成生物标记物的人体应用尚未进入关键试验。 目前,在临床试验中进展最快的合成生物标记物是聚乙二醇化肽,根据最近一期研究的初步数据,健康志愿者对其耐受性良好且安全。
合成生物标记物的前几个临床应用案例需要仔细考虑,因为早期失败可能会使该领域倒退。筛查无症状患者的早期癌症是一项极具挑战性的工作,在临床试验验证研究中可能会带来伦理挑战。例如,合成生物标记物检测结果呈阳性的患者可能需要等待成像确认 (即允许肿瘤生长 ),然后才能进行治疗干预。潜在的临床切入点,如治疗反应的药效学评估或首次切除术后复发的监测,可以检测合成生物标记物方法的效用。
值得注意的是,随着该领域向人体试验的发展,构成合成生物标记物的许多组件和载体正在进行临床评估,在人体内有已证明的安全记录,或已获得FDA批准。例如,用于术中检测肿瘤边缘的成像探针中使用的蛋白酶激活底物。同样,对于基因编码的合成生物标记物,许多临床试验都强调了减毒细菌作为靶向肿瘤和提供治疗的载体的安全性和实用性。这些先例提供了对合成生物标记物实施例的更广泛理解,这些合成生物标记物将是安全的,并在人类耐受性良好。
尽管合成生物标记物这一新兴领域令人兴奋且充满希望,但我们目前对癌症发病机制的认识还存在一些空白,需要在应对技术挑战的同时加以填补,以指导未来的进展。 特别是,对早期病变的生物学以及前体病变何时和如何转化为恶性肿瘤的理解有限,但需要这些信息来指导传感器工程策略。 这突出了合成生物标记物领域对癌症早期检测的挑战。
此外,还有许多问题需要回答。例如,对哪些早期肿瘤或癌前病变可以推动传感器的工程化?机器学习如何支持识别复杂生物数据集中的关键特征,以实现合成生物标记物所需的预测能力?哪些人群将从早期检测中受益最大?患者多久可以接受一次筛查?在什么情况下可以使用相同的探针检测癌症复发?与目前的护理标准相比,对“高危”患者进行长期监测的成本有多高?如何克服患者和肿瘤的异质性以确保诊断的准确性?
尽管目前的未知数似乎比得到的答案更多,但我们可以相信,通过多学科的努力,以及科学家大胆创新的愿景,解决方案将以越来越快的速度出现。
参考文献:
1.Synthetic biomarkers: a twenty-firstcentury path to early cancer detection. Nat Rev Cancer. 2021 Oct; 21(10):655–668.
链接:http://www.lewenyixue.com/2024/07/03/%E6%9C%AA%E6%9D%A5%E7%9A%84%E6%97%A9%E6%9C%9F%E7%99%8C%E7%97%87%E6%A3%80%E6%B5%8B%E6%96%B9%E6%B3%95%EF%BC%9A%E5%90%88%E6%88%90%E7%94%9F%E7%89%A9%E6%A0%87%E5%BF%97%E7%89%A9/





赶快来坐沙发