【Nature子刊】南京大学华子春/庄红芹团队揭示“最毒乳腺癌”治疗新策略

作者:Jerry
导读: 三阴性乳腺癌(TNBC)细胞的高基础自噬和增强的线粒体裂变支持细胞迁移,促进癌细胞代谢的可塑性。在这里,研究人员提出了一种针对Drp1介导的线粒体分裂和自噬途径的新型联合治疗TNBC的方法。
6月28日,南京大学华子春/庄红芹研究团队在期刊《Cell Death&Disease》上发表了题为“ADT-OH exhibits anti-metastatic activity on triple-negative breast cancer by combinatorial targeting of autophagy and mitochondrial fission”的研究论文, 该研究证明了5-(4-羟基苯基)- 3h -1,2-二硫基-3-硫酮(ADT-OH)是最广泛使用的缓释H2S供体之一,在体外和体内没有增殖抑制的情况下有效抑制TNBC细胞的转移。

https://www.nature.com/articles/s41419-024-06829-w#Sec27
背景知识
01
根据GLOBOCAN 2020,乳腺癌患者的比例已经超过肺癌,成为最常见的恶性肿瘤。在所有新诊断的乳腺癌中,三阴性乳腺癌(TNBC)在所有乳腺癌中死亡率最高,约占15-20%。由于TNBC的分子异质性和缺乏明确的分子靶点,针对最具侵袭性的乳腺癌亚型TNBC的靶向治疗仍然有限,传统化疗仍然是标准的治疗方法。然而,对于转移性TNBC患者没有标准的化疗方案。因此,迫切需要新的靶向治疗TNBC,特别是转移性TNBC。
代谢重编程是公认的癌症特征之一,赋予癌细胞在不适宜的微环境中适应的能力,包括由抗癌疗法产生的应激环境。在这些代谢适应中,包括TNBC细胞在内的癌细胞使用糖酵解和线粒体氧化来产生ATP,并通过自噬或如线粒体自噬等特定形式的自噬来循环利用细胞组分。自噬可以作为TNBC细胞的生存途径和抵抗化疗药物的机制而被激活。因此,抑制自噬被认为是治疗TNBC的一种有前途的策略。然而,单独抑制自噬对于TNBC治疗通常被认为是辅助策略,在TNBC的体外模型中用于提高化疗效率。为了解决TNBC体外模型中自噬抑制的有限效能问题,有人进一步提出,针对自噬和线粒体功能的组合性靶向,而不是单独的自噬抑制,将是治疗基底样乳腺癌的有效方法。
最新成果
02
在3种具有不同转移潜能的乳腺癌细胞系,包括2种典型的TNBC细胞系MDA-MB-231、4T1-luci和1种非TNBC细胞系MCF-7中,研究人员分析了ADT-OH对乳腺癌细胞的体外作用。首先,研究人员采用CCK-8法评估细胞活力并确定合适的药物浓度。如图1A所示,高浓度ADT-OH可以显著降低三种乳腺癌细胞系的增殖。虽然ADT-OH对所有乳腺癌细胞系的增殖均呈剂量依赖性,但MCF-7细胞系的IC50(最大半数抑制浓度)值低于TNBC细胞系。这些结果表明,非TNBC细胞系MCF-7对ADT-OH比TNBC细胞系更敏感。然而,伤口愈合和细胞迁移实验显示,与MCF-7细胞系相比,ADT-OH(≤50 μM)处理能显著抑制TNBC细胞系的迁移,无论是垂直迁移还是横向迁移。此外,从图1B-E可以看出,非TNBC细胞系MCF-7的迁移能力比MDA-MB-231细胞系和4T1-Luci细胞系至少低5倍。综上所述,这些结果证实,具有较高迁移能力的TNBC细胞在处理后的细胞迁移显著减少是由于ADT-OH(相对较低浓度)对细胞迁移行为的影响,而不是由于细胞增殖的减少。
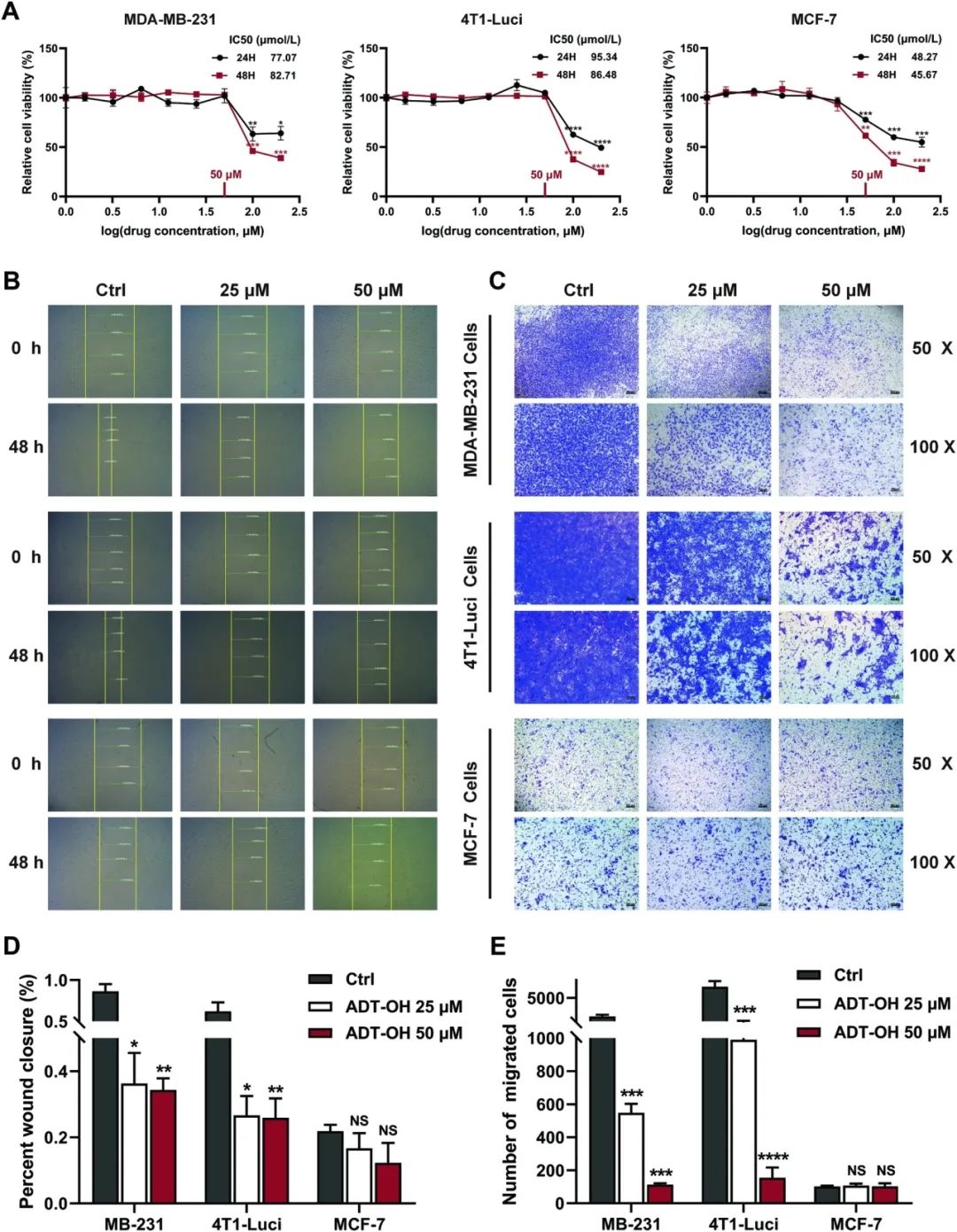
图1:ADT-OH对乳腺癌细胞增殖和转移能力的影响
研究结论
03
总之,研究人员在这里开发了一种新的策略,能够整合靶向线粒体分裂和自噬途径来治疗转移性TNBC。ADT-OH通过抑制TNBC细胞的线粒体分裂和自噬,在体内和体外均对TNBC转移有明显的抑制作用。此外,研究人员赋予CD-ADT-OH在药物递送方面的实际溶解度和对TNBC转移的药物功效。考虑到侵袭性肿瘤中自噬和线粒体分裂的普遍上调,ADT-OH的潜在应用范围已超出TNBC,本研究结果表明CD-ADT-OH在探索临床应用方面具有广阔的前景。
参考资料:
https://www.nature.com/articles/s41419-024-06829-w#Sec27
链接:http://www.lewenyixue.com/2024/07/03/%E3%80%90Nature%E5%AD%90%E5%88%8A%E3%80%91%E5%8D%97%E4%BA%AC%E5%A4%A7%E5%AD%A6%E5%8D%8E%E5%AD%90%E6%98%A5-%E5%BA%84%E7%BA%A2/




 知道|国家药品不良反应监测年度报告(2024年)
知道|国家药品不良反应监测年度报告(2024年)
赶快来坐沙发