【专题论坛】结直肠息肉的规范化诊疗
引用本文 : 王人杰, 张晓兰, 蔡继东, 等. 结直肠息肉的规范化诊疗[J]. 中华胃肠外科杂志, 2024, 27(6): 583-590. DOI: 10.3760/cma.j.cn441530-20240416-00143.
作者: 王人杰 张晓兰 蔡继东 王铭河 刘建强 徐烨
作者单位:复旦大学附属肿瘤医院大肠外1科 复旦大学上海医学院肿瘤学系 复旦大学附属肿瘤医院内镜科 复旦大学上海医学院肿瘤学系
摘要
结直肠息肉的规范化处理,包括分型、治疗、随访和预防控制等多个方面。针对不同类型的息肉需采用相应的治疗方案,包括内镜下切除和外科手术。目前对于 pT1 期的 “恶性息肉”是选择内镜下切除还是外科手术还有所争议。本文结合最新文献及指南就息肉的分型及治疗方式、随访及预防控制分别进行阐述。规范化处理结直肠息肉对于降低结直肠癌的发病率、提高早期结直肠癌的治愈率,具有重大意义。
结直肠息肉是一种从肠黏膜表面突出生长到肠腔内的隆起性病变。在未经病理学确诊之前,一般被统称为息肉。该病起病隐匿,通常在进行内镜检查时被发现。在我国, 50 岁而无症状并具备平均风险的人群中,结直肠息肉的发生率超过 25% [1] 。随着年龄增长,结直肠息肉的患病率也随之增加,超过 50 岁被认为是息肉发生的独立危险因素 [2] 。男性的结直肠息肉发生率明显高于女性,吸烟、饮酒和高脂饮食被认为是结直肠息肉的危险因素;相反,高纤维饮食则被认为是一种保护因素 [3-4] 。此外,遗传因素也是结直肠息肉的发生因素之一 [5] 。结直肠息肉可以发生于肠道的各个部位,形态各异、大小不一,数目不等。根据息肉的病理类型,有相当一部分结直肠息肉属于癌前病变。因此,选择合理的处理方式是临床医生面临的重要问题。然而,目前在国内对结直肠息肉的诊断和治疗尚缺乏共识。本文通过归纳和总结国内外相关文献,旨在为临床提供参考。
根据息肉表面形态,运用内镜成像系统可以进行分型诊断,并评估其黏膜下浸润深度,从而为治疗方式的选择提供重要的参考依据。
(一)根据大小分类
微小息肉:直径 <5 mm ;小息肉: 5 mm≤ 直径 <10 mm ;大息肉: 10 mm≤ 直径 <20 mm ;巨大息肉:直径 ≥20 mm 。
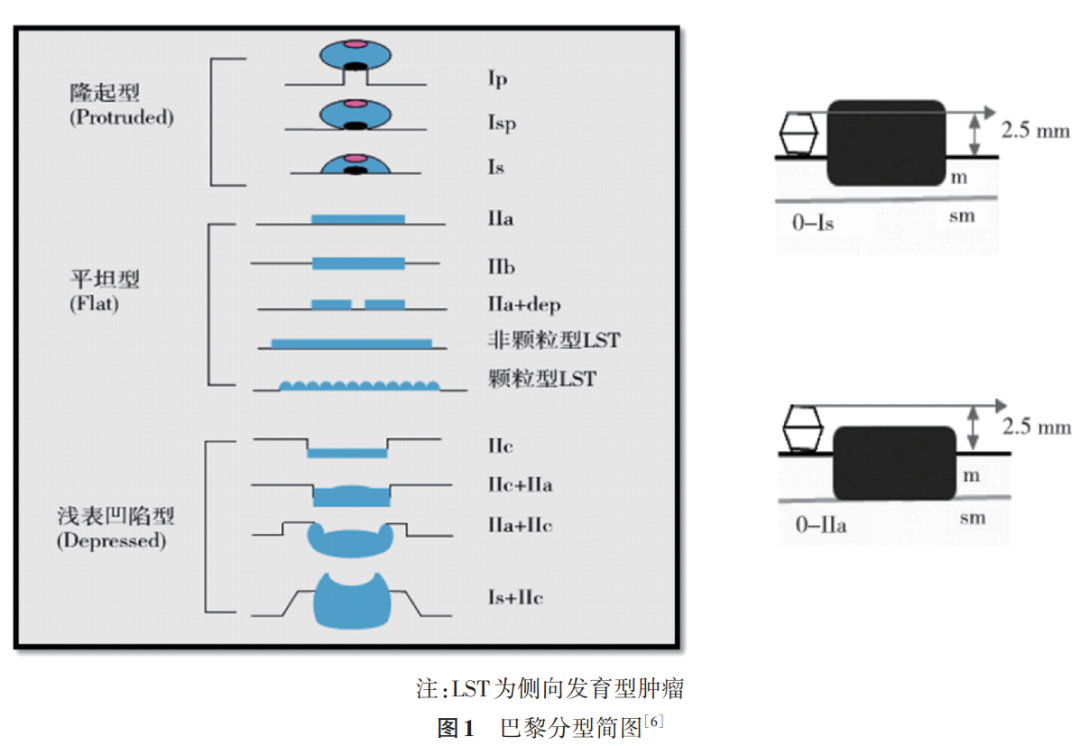
(二)白光内镜下巴黎分型
根据白光内镜下的形态学特征,欧洲胃肠内镜学会建议,结直肠息肉的大体形态使用巴黎分型描述,见图 1 [6] ;本中心内镜所见的巴黎分型典型图片见图 2 、图 3 和图 4 。 Ⅱc+Ⅱa 和 Ⅱa+Ⅱc 等混合型病变往往黏膜下浸润的风险较大,需要结合染色、放大内镜或超声内镜综合评估以确定黏膜下浸润深度。内镜切除后,需要结合病理判断是否需要外科干预。凹陷型病变( 0~Ⅲ )代表黏膜下层浸润,一般不适合内镜下切除。因此,临床医生可根据巴黎分型初步判断病变切除方式。
(三)侧向发育型肿瘤( laterally spreading tumor , LST )
LST 为直径 >10 mm 的无蒂息肉,沿管腔侧向匍行生长,而非垂直于管壁隆起性生长。根据表面形态可分为颗粒型( LST - G )和非颗粒型( LST - NG ), 前者又分为颗粒均一型( LST - G - H )和结节混合型( LST - G - M ),后者又分为扁平隆起型( LST - NG - F )和假凹陷型( LST - NG - PD )。见图 5 。
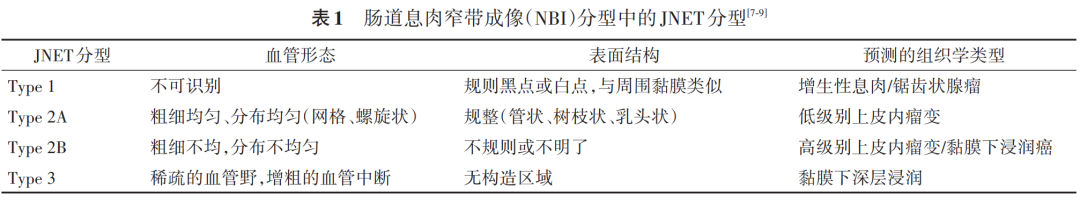
(四)窄带成像( narrow band imaging , NBI )分型
虽然白光内镜下可以通过巴黎分型对结直肠息肉的大体形态进行描述并分型诊断,但对于病理预估及后续治疗方式的选择仍具局限性。自从能够显示病变表面微结构的 NBI 技术问世以来,联合放大内镜的应用,大大提高了对病变评估的准确性。但对于 NBI 观察息肉的分类较多,包括根据 pit 结构分类的工藤分型、根据血管分型的佐野分型及表面微血管与 pit 结构相结合的 NICE 分型和 JNET 分型等。但 NICE 分型很难将高级别瘤变或浅层黏膜浸润癌与低级别瘤变区分开来,基于此缺陷,较多运用 JNET 分型。该分型根据表面 pit 结构及微血管形态分为 4 型 [7-9] 。见表 1 。
根据组织病理学,息肉可分为肿瘤性息肉和非肿瘤性息肉。
(一)肿瘤性息肉
肿瘤性息肉可分为腺瘤性息肉和锯齿状病变两大类。
1. 腺瘤性息肉:是结直肠最常见的良性肿瘤,由异型增生的腺上皮构成,会进展为癌,分为管状、绒毛状和绒毛管状。腺瘤性息肉体积越大,越容易发生癌变。根据腺瘤的异型增生程度分为低级别或高级别上皮内瘤变。腺瘤性息肉属于癌前病变,绒毛状腺瘤较绒毛管状和管状腺瘤易癌变,其 JNET 分型通常为 Type 2A 型。
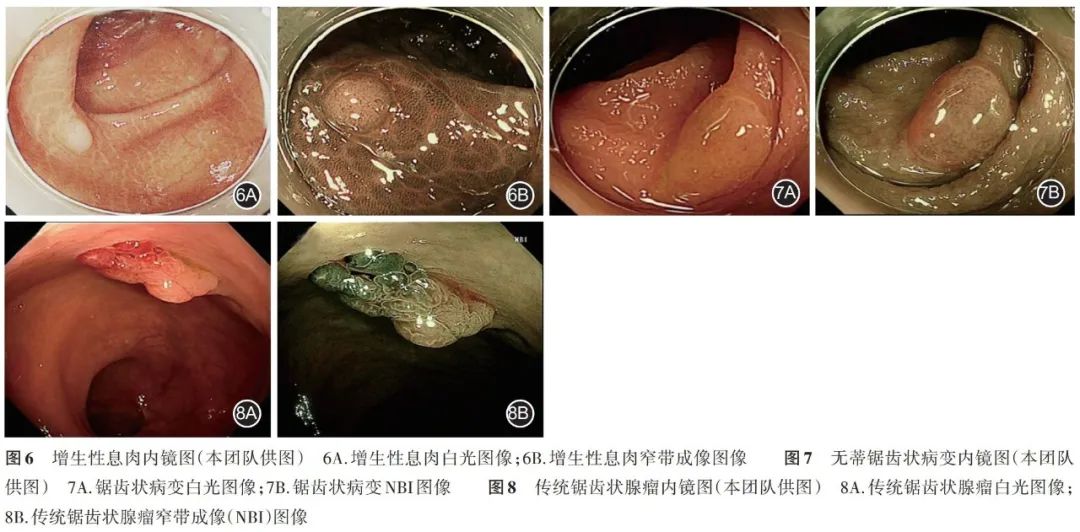
2. 锯齿状病变: 2010 年,世界卫生组织( WHO )将结直肠锯齿状病变分为 3 类,即增生性息肉、无蒂锯齿状腺瘤(或息肉)和传统锯齿状腺瘤。 2019 年, WHO 又将无蒂锯齿状腺瘤(或息肉)命名为无蒂锯齿状病变。此外,还增加了未分类的锯齿状病变。( 1 )增生性息肉( hyperplastic polyp , HP ):是最常见锯齿状病变的亚型,锯齿状息肉的 70%~95% 为 HP [10] 。全结肠息肉的 25%~30% 为 HP [11] 。其特征是缺乏恶变潜能。 JNET 分型通常为 Type 1 型。见图 6 。( 2 )无蒂锯齿状病变( sessile serrated lesion , SSL ): SSL 占结直肠息肉的 0.18%~20.23% ,具有恶性潜能。欧美人群发生率高,东亚人群为 0.4% 。通常位于右半结肠,表现为平坦型病变,直径多 >10 mm ,呈灰白色改变,表面具有黏液帽。 NBI 观察可见隐窝开口处黑点, JNET 分型多为 Type1 型。见图 7 。( 3 )传统锯齿状腺瘤( traditional serrated adenoma , TSA ): TSA 更常出现在左半结肠,是最不常见的结直肠锯齿状病变。通常, TSA 比 SSL 大,白光观察呈红色,隆起或带蒂病变,肉眼观察为 “松果状”或“珊瑚树枝状”病变。组织学上, TSA 表现为扭曲的绒毛状(丝状)或管状绒毛状结构,在许多情况下,绒毛有球根状顶端, JNET 分型多为 Type2A 型。见图 8 。( 4 )无法分类的锯齿状腺瘤( serrated adenoma - unclassified , SAU ):指无法分类的具有锯齿状结构而发育不良的息肉,具有与其他锯齿状病变不同的形态和分子特征。
(二)非肿瘤性息肉
1. 炎性息肉:最常见,多见于炎性肠病,也可见于血吸虫或肠阿米巴等感染性或缺血性肠炎。息肉通常较小,有蒂或无蒂,大多 <2 cm 。
2. 错构瘤性息肉:是肠道较为少见的非肿瘤性息肉,常伴发于一些罕见的遗传性肿瘤综合征,包括幼年性息肉病、 PeutzJeghers 综合征( PJ 息肉)、 Cowden 综合征及 Cronkhite Canada 综合征。
随着内镜技术的不断更新,对于提高息肉的检出及协作诊断,更多的软硬件在不断推陈出新。如具有拉展皱褶功能的头端辅助工具的迭代、可拓展视野的广角内镜、具有可观察细胞形态 “活体活检”功能的激光共聚焦内镜,甚至人工智能技术等都在参与到息肉的诊断中。
目前比较常用的内镜下切除方式包括活检钳切除( forcep biopsy polypectomy , FBP )、冷圈套息肉切除术( cold snare polypectomy , CSP )、热圈套息肉切除术( hot snare polypectomy , HSP )、内镜下黏膜切除术( endoscopic mucosal resection , EMR )以及内镜黏膜下剥离术( endoscopic submucosal dissection , ESD )等。根据息肉大小及 NBI 预估病理类型分类,选择合适的内镜切除方式既能提高切除率,又能降低并发症。
(一)直径 <5 mm 的息肉
对这类息肉,根据不同的病理类型及分布的结肠节段,处理的方式也不同。
1. 腺瘤性息肉:对于 <5 mm 的腺瘤型息肉,原则上也是需要内镜下切除和内镜的随访复查。对于平坦凹陷型的肿瘤性病变,即使直径 <5 mm ,也必须行内镜下切除。然而,根据患者的年龄、总体情况、并发症及个人意愿,对于微小病变可行内镜随访 [12] 。
2. 增生性息肉:直径 <5 mm 、位于直乙状结肠的白色平坦增生性息肉,因为既往没有这类病变转变为腺瘤的报道,故建议随访 [13] 。对于该类息肉首选推荐行 CSP 。使用活检钳的冷钳息肉切除术限于直径 <3 mm 的病变 [14] 。但对于有癌变倾向的平坦凹陷型病变,即使直径 <5 mm ,也应避免 CSP [12] 。
(二) 5 mm≤ 直径 <10 mm 的息肉
因为直径 ≥5 mm 的息肉癌变发生率高于 <5 mm 的病变,且可通过内镜判断是良性腺瘤还是癌,因此,强烈推荐内镜下切除。冷切除仍是首选。推荐 CSP 用于直径 <10 mm 的非带蒂结直肠息肉。带蒂结直肠息肉内部常存在相对较粗的滋养血管,推荐使用 HSP [15] 。
(三) 10 mm≤ 直径 <20 mm 的息肉
1. 无蒂息肉:对于 LST - G - M 中大结节、及 LST - NG - PD 存在黏膜下浸润可能、且与大小及 pit 形态无关的,均需要完整切除 [16-17] 。对于腺瘤型 LST - G - H ,可通过分片 EMR 切除 [17] 。 LST - NG - F 的治疗需根据术前评估。总而言之,选择 ESD 还是 EPMR ,都是基于 LST 的亚型,放大内镜和超声内镜需要用于术前评估 [12] 。对于 10 mm≤ 直径 <20 mm 的非浸润性病变,因可降低切除后出血不良事件发生率,推荐冷圈套息肉切除术或冷 EMR 术 [18] 。完整切除,是预防结直肠癌的关键。如存在癌变倾向,建议 ESD 完整切除。
2. 带蒂息肉:目前指南推荐,带蒂息肉切除方法基于息肉的大小和蒂的长度。息肉头端 <20 mm 、蒂长 <5 mm 的息肉,推荐热圈套切除息肉。息肉头端 ≥20 mm 、蒂长 ≥5 mm 的息肉,多数蒂部存在粗大血管,为避免出血,推荐使用稀释肾上腺素黏膜下注射,可拆卸套扎装置结扎蒂部后再行切除 [19] 。综上所述,不推荐将 CSP 用于切除直径 ≥10 mm 的带蒂结直肠息肉 [15] 。
(四)直径 ≥20 mm 的息肉
非浸润性无蒂病变,推荐行 EMR 或 ESD 切除。对于直径 ≥20 mm 的病变,癌变的风险更大。基于术前精准的放大内镜,直径 ≥20 mm 的腺瘤或腺瘤中局灶癌变的病灶,在没有干扰病理诊断的前提下,运用避开癌变区域、精准分片 EMR 方式切除 [20] 。即使与分片切除相关的局部复发高于完整切除,但绝大部分局部复发病变都是腺瘤 [21-22] 。无论病变大小, ESD 均可完整切除,但结肠 ESD 对于内镜医生来说难度较大,且需要丰富的经验方可顺利完成。
结直肠息肉是大多数结直肠癌的癌前病变 [23] 。仅在上皮、黏膜固有层或黏膜肌层中有高度异型增生的病变,在 AJCC 分期和 NCCN 指南中被分类为 “ Tis ” [24-25] 。病理医生有时会使用原位癌或黏膜内癌等术语来描述这些病变,但它们不应与浸润性癌相混淆。高度异型增生腺瘤的治疗推荐应仅为内镜切除,因为在完全内镜切除后,这些病变在肠壁或淋巴结中没有肿瘤的残留。
结直肠息肉的外科治疗主要包括 3 个方面:即无法通过内镜切除的良性息肉、内镜下具有浸润性特征的 “恶性息肉”以及“恶性息肉”内镜下切除后需要追加根治性外科手术以降低复发和转移的情况。
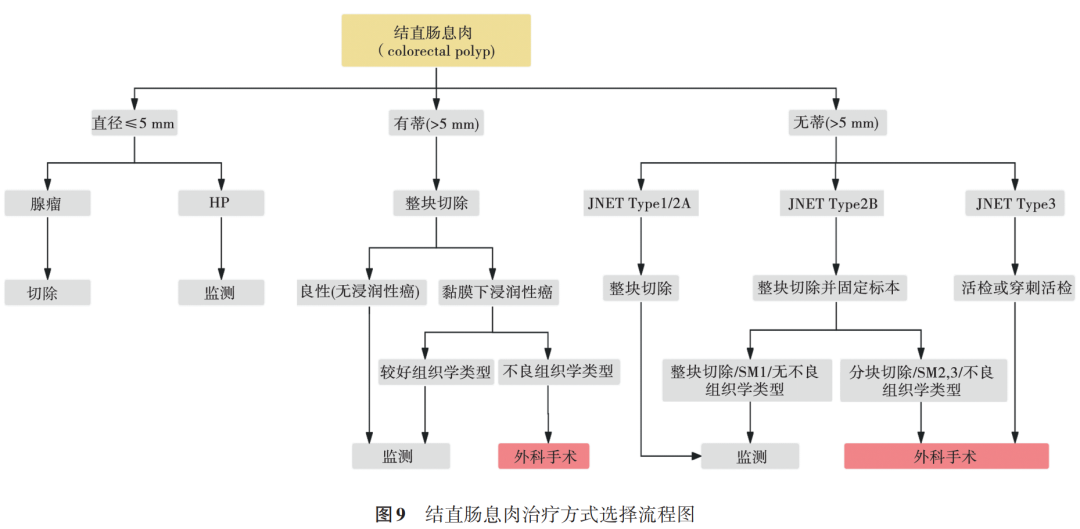
结直肠息肉总体的癌变率在 0.2%~5.0% 之间 [26-28] 。 “恶性息肉”特指侵入黏膜下层但未达到肌层的结直肠病变。这一病变在肿瘤 TNM 分期系统中被归类为 pT1 [24] 。 由于黏膜下层的肿瘤浸润可能会导致淋巴和血道转移, “恶性息肉”一直是选择内镜下切除还是外科手术存在争议的话题 [29-30] 。总体来说, “恶性息肉”是否需要外科手术,主要取决于肿瘤的性质和大小、组织学的类型和浸润深度、临床症状和并发症以及患者的整体状况和治疗意愿 [31] 。本文结合最新的临床指南,绘制了结直肠息肉治疗方式选择流程图供参考,见图 9 。
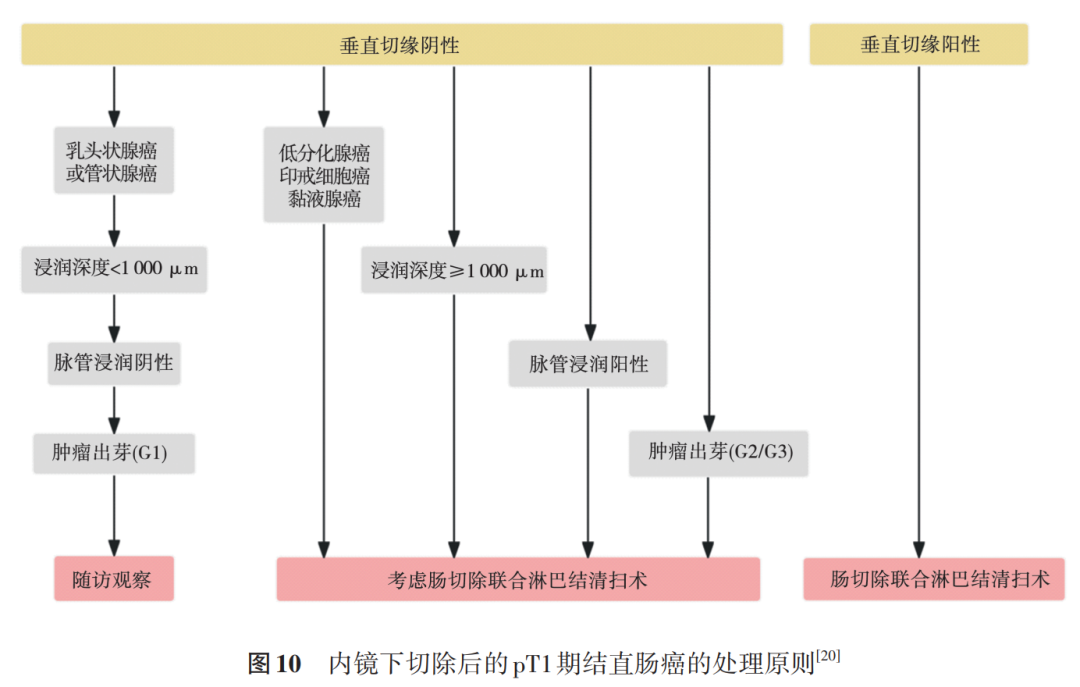
对于 “恶性息肉”内镜下切除后是否需要追加外科手术,日本结直肠癌学会 2019 年所发,即垂直切缘阳性和存在高危因素如: T1b ( SM 侵袭深度 ≥1 000 µm )、淋巴脉管浸润阳性、低分化腺癌、或印戒细胞癌、或黏液腺癌,在最深浸润处出现 BD2/3 级别的出芽。见图 10 [20] 。
合适的内镜随访间期是基于腺瘤数量、最大息肉尺寸和切除病变后组织病理学表现而定的 [32-33] 。对于 <5 mm 的小腺瘤息肉的管理,目前仍无统一意见。
1. 传统腺瘤的随访推荐: 1~2 个直径 <10 mm 的传统腺瘤的患者,推荐 7~10 年随访复查; 3~4 个 <10 mm 的普通腺瘤,推荐监测区间为 3~5 年,并非严格的 3 年。 5~10 个 <10 mm 的腺瘤或高危腺瘤(高级别上皮内瘤变或绒毛成分),仍然随访为 3 年内。 10 个以上腺瘤的患者,目前推荐每年均需随访。对于大息肉的分片切除具有残留和复发的风险,因此推荐 6 个月内进行随访 [34] 。
2. 锯齿状病变的随访推荐: 1~2 个直径 <10 mm 的 SSL 的患者,推荐 5~10 年内行随访复查; 3~4 个直径 <10 mm 的 SSL 或 ≥10 mm 的增生性息肉, 3~5 年内需要复查; 5~10 个直径 <10 mm 的发育不良的 SSL 或 TSA ,推荐监测间期为 3 年。
鉴于结直肠息肉是结直肠癌的癌前病变,预防和控制结直肠息肉的发生显得至关重要。其关键是采取一系列健康的生活方式和策略,包括饮食习惯、锻炼、定期筛查和遗传因素的管理 [35-36] 。高纤维、低脂肪饮食,减少红肉和加工肉的摄入量,以及避免过量饮酒和吸烟,是降低结直肠息肉风险的重要措施。定期锻炼不但有助于维持身体健康、也能降低结直肠息肉的风险。此外,定期筛查也是预防结直肠息肉的重要手段。建议在 50 岁时开始进行结直肠癌筛查,特别是肠镜检查,并根据医生的建议定期复查。最后,对于具有家族史或遗传倾向的个体,及时进行基因检测和遗传咨询,也是预防结直肠息肉的重要措施。综上所述,通过健康的生活方式、定期筛查以及遗传因素的管理,可以有效预防和控制结直肠息肉的发生,降低罹患结直肠癌的风险。
综上所述,结直肠息肉的规范化处理包括分型、治疗、随访和预防控制等多个方面,其最佳的诊疗模式需要内镜医生、外科医生、病理科医生、肿瘤科医生以及社区医生的通力协作。结直肠息肉的诊疗需要与时俱进,随着现代技术的飞速发展,结直肠息肉的诊断会更加精确,切除技术会更加完善,随访筛查也会更个体化。结直肠息肉的规范化处理对于降低结直肠癌的发病率、提高早期结直肠癌的治愈率,具有重大意义。
利益冲突 所有作者声明无利益冲突
滑动阅读参考文献
链接:http://www.lewenyixue.com/2024/07/03/%E3%80%90%E4%B8%93%E9%A2%98%E8%AE%BA%E5%9D%9B%E3%80%91%E7%BB%93%E7%9B%B4%E8%82%A0%E6%81%AF%E8%82%89%E7%9A%84%E8%A7%84%E8%8C%83%E5%8C%96%E8%AF%8A%E7%96%97/






 知道|国家药品不良反应监测年度报告(2024年)
知道|国家药品不良反应监测年度报告(2024年)
赶快来坐沙发