【CACA周刊】69期 放疗诱导前药激活与ADC的碰撞
本期看点
序言
目前,尽管靶向治疗已有了长足发展,但在临床实践中,联合放化疗仍是超过50%的肿瘤病人的一线治疗方案。“去化疗”道阻且长,化疗仍是最常见的肿瘤治疗方案。
传统化疗药物种类繁多,常见如多柔比星、喜树碱类、吉西他滨、5-FU、铂类药物等都遵循相似的作用模式,如干扰DNA复制、RNA转录、阻断细胞分裂、抑制拓扑异构酶等等。但是,化疗药物往往不能区分肿瘤细胞和健康细胞,因此具有不可避免的全身毒性。
为减少全身毒性,克服化疗药物水溶性差、对癌细胞的选择性差、存在多药耐药性以及最大耐受剂量低等固有局限性,开发基于前药的化疗治疗策略成为癌症治疗的重要研究方向之一。
前药指药物经化学结构修饰之后在体外无活性或活性较低,在体内经过不同途径转化后释放出一个或多个活性代谢产物而发挥药效的化合物。
早期的前药是为了改善药物的溶解性、细胞渗透性和化学稳定性;近年来,前药的设计主要是为了克服化疗药物的全身毒性问题。
通过合理的前药设计,化疗药物可以增强化学及代谢稳定性、改变水溶性和脂溶性等方式来实现改变血脑屏障渗透性、延长药物作用时间并提高生物利用率、提高靶向性、减轻不良反应、克服耐药等目的。
目前,较为成熟的前药激活策略主要依靠肿瘤微环境特征如低氧、酸性、特殊的酶、活性氧等实现前药的内部激活或通过可见光和X射线等实现前药的外部激活。
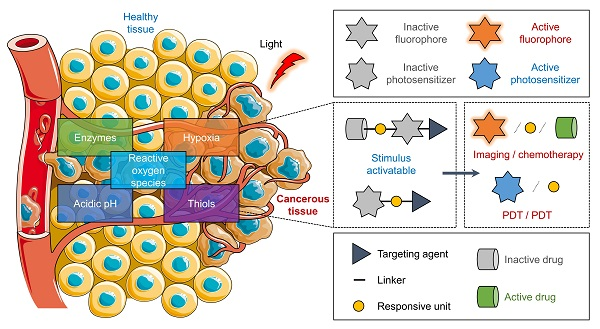
基于核苷磷酸酯和膦酸酯的内部激活前药以及外部激活的光动力疗法已经广泛进入临床应用,收获众多好评。
2024年4月1日,北京大学刘志博教授团队在 Nature Chemistry 刊文,为接受放疗联合化疗的患者提供了一种新颖的、能够减少化疗全身毒性的理想解决方案——X射线激活的ADC前药。
现代放射技术能够实现“三维适形”的精确放射,在对肿瘤提供高剂量辐射的前提下对肿瘤周围健康组织造成最小的损害。由于放疗和化疗的临床相关性、放疗的高组织穿透性和现代技术的精确靶向性,X射线成为控制药物释放的最佳外源刺激之一。
早在20世纪90年代,使用放疗进行前药激活的策略就已经被尝试过了,但是由于技术的局限性,当时的激活模式效率和精确度并不高。近年来的放疗前药激活主要通过电离水产生的羟基自由基、氢自由基和水合电子等来进行前药激活。
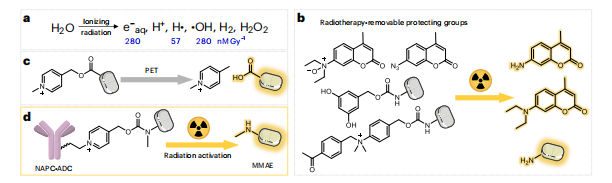
为改良该技术,研究团队利用光致电子转移化学技术将N-烷基-4-picolinium(NAP)作为保护基团,通过化学合成或生物合成的方法将原型药的活性位点进行修饰,使其失去药理活性而转化为低毒性或无毒性的前药。
当前药到达接受X射线照射的肿瘤区域时,修饰后的前药与水合电子反应,将修饰基团解离,释放原型药分子,即可在保证对正常组织和细胞影响最小化的同时杀伤肿瘤,实现肿瘤精准治疗的目的。
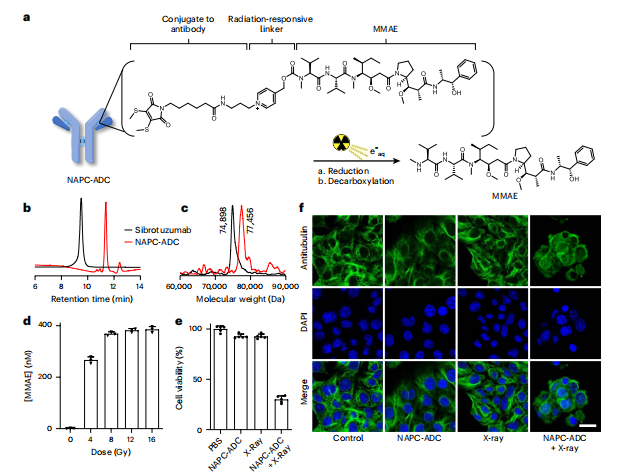
NAP作为迄今为止最有效的放射可去除的保护基团,在生理条件下对水合电子的活性更高。该研究为下一代ADC的研究提供了新的思路,有望为难治性肿瘤提供更可靠的治疗方案,或将开启精准化疗的新时代。
不难想象,如果将抗肿瘤药物制成可通过X射线激活的前药,给药后由于前药本身的低毒性,可有效降低其对患者产生的系统毒性。在接受放射治疗时,X射线针对肿瘤区域的辐射能够激活肿瘤区域内的前药分子释放其药效,从而实现针对肿瘤的精准杀伤,并有效降低药物分子对正常组织产生的副作用。
医术观澜
……
1-
4月16日, Nature Medicine :天津医科大学肿瘤医院李祥春教授、陈可欣教授,郑州大学第一附属医院李文才副教授等开发了能准确预测 不明起源肿瘤 类型的AI模型,准确率大幅优于传统方法 [1] 。
原发灶不明肿瘤(CUP)是一类通过组织病理学确认为转移性肿瘤、但无法通过常规诊断确定其起源的恶性疾病。
该研究开发了一种基于深度学习的AI模型——TORCH,该模型可以成为鉴别恶性肿瘤和良性疾病、肿瘤起源定位以及辅助CUP患者临床决策的宝贵工具,其在5个测试集中取得了稳健的诊断和预测结果,媲美甚至超过了人类病理学专家。
该研究选用20638名患者的29883张细胞学涂片作为训练集,以训练TORCH;在由10974名患者、12799张图像组成的三个内部测试集以及由12076人、14538张图像组成的两个外部测试集中,对TORCH进行测试。

研究显示TORCH性能优良,top-1准确率、top-3准确率分别达到82.6%、98.9%,明显优于传统方法。分析结果还提示,TORCH预测结果与初始治疗方案一致,与患者更好的总生存期相关。
综上可知,TORCH作为临床实践中有价值的辅助工具的潜力,或可为CUP患者指导最佳治疗策略,避免不必要的手术并进一步延长总生存期,未来值得在前瞻性随机试验中进行深入研究。
2-
4月17日, Science Translational Medicine :温州医科大学附属台州医院毛鑫礼教授、叶丽萍教授及武汉大学人民医院于红刚教授等发了一种人工智能系统,它可以提高食道癌与癌前病变的检出率 [2] 。
该研究团队使用从中国多家医疗机构收集的超过19万张食道图像的数据集构建了名为ENDOANGEL-ELD的深度学习架构。
团队进行了一项临床试验(该试验样本为3117名接受内窥镜检查的患者),并将人工智能系统应用于其中的1556名患者。与对照组(含1561名患者)相比,该深度学习系统将高危食道病变的检出率提高了一倍(0.9% vs 1.8%)。此外,ENDOANGEL-ELD显示的敏感性和特异性都很高,分别为89.7%和98.5%,并且在患者中也未发生不良反应。这种新的方法或可实现早期食道癌的提前诊断和及时治疗。
药事纵横
……
1-
4月5日, AACR 2024 :用于R/R NHL患者的新型CD19 CAR-T细胞疗法Ⅱ期研究(HRAIN01-NHL01-Ⅱ)初步结果公布 [3] 。
HRAIN01-NHL01-Ⅱ是一项在中国开展的开放标签、单臂、17中心研究。该研究纳入了接受过至少两线治疗(必须含蒽环类药物和CD20靶向药物)或自体造血干细胞移植后的R/R NHL患者。所有患者均接受了2.0×10 6 CAR-T细胞/kg剂量的HR001单次输注。
研究结果显示,截至2023年5月16日,81例基线时ECOG 0~1分的R/R NHL患者接受了HR001输注。3.7%为CD19阴性,91.4%为DLBCL,79.0%为Ann Arbor/Lugano Ⅲ~Ⅳ期。
中位缓解时间为30天(范围28~358天)。3个月、6个月最佳ORR分别为53.1%(95% CI:41.7~64.3)、45.7%(95% CI:34.6~57.1)和74.1%(95% CI:63.1~83.2)。3个月、6个月和最佳CRR分别为32.1%(95% CI:22.2~43.4)、29.6%(95% CI:20.0~40.8)和49.4%(95% CI:38.1~60.7)。中位DOR和PFS分别为339天(95% CI:149~NE)和176天(95% CI:91~NE)。OS尚未达到。
最常见的TRAEs发生在血液系统。95.1%的患者发生了CRS,其中3.7%的患者发生了≥3级CRS。8.6%的患者发生了ICANS,未发生≥3级ICANS。治疗相关死亡率为1.2%。
CAR-T细胞扩增的中位时间为输注后240小时(范围120~672),中位最大扩增量(Cmax)为17413.9拷贝/μg DNA(124.9~136382.2),中位AUC0-28d为3201014.0拷贝/μg DNA(205082.8~18400016.2)。14.8%的患者抗药物抗体检测结果呈阳性,3.7%的患者中和抗体检测结果呈阳性。在中和抗体阳性患者中,完全缓解持续至随访。
研究认为R/R NHL患者可从HR001治疗中获益,客观缓解率高,疗效持久,安全性好。
医谷回声
……
1-
4月2日, JAMA :针对未接受辅助或新辅助化疗的早期TNBC患者的研究分析了肿瘤浸润淋巴细胞水平、癌症复发和生存之间的关系 [4] 。
研究方案为对13个参与中心的个体患者水平数据进行回顾性汇总分析,纳入诊断为TNBC的1966名参与者接受手术治疗并加或不加放疗但未接受辅助或新辅助化疗的患者。主要结局是iDFS,次要结局是RFS、无远处复发生存期(DRFS)和OS。
研究结果显示,本研究纳入了1966名TNBC患者(中位年龄56岁[IQR:39~71];55%为Ⅰ期TNBC)。中位TIL水平为15%(IQR:5%~40%)。417人(21%)的TIL水平为50%或更高(中位年龄,41岁[IQR:36~63]),1300人(66%)的TIL水平低于30%(中位年龄),59岁[IQR:41~72])。对于TIL水平为50%或以上的患者,Ⅰ期TNBC的五年DRFS为94%(95% CI:91%~96%),而TIL水平为50%或以上的患者为78%(95% CI:75%~80%)。TIL水平低于30%的人;TIL水平为50%或以上的患者的5年总体生存率为95%(95% CI:92%~97%),而TIL水平为50%或以上的患者的5年总体生存率为82%(95% CI:79%~84%)。TIL水平低于30%。中位随访18年,调整年龄、肿瘤大小、淋巴结状态、组织学分级和接受放疗后,TIL增量每增加10%与iDFS改善独立相关(HR:0.92 [0.89~0.94])、RFS(HR:0.90[0.87~0.92])、DRFS(HR:0.87[0.84~0.90])和总生存率(0.88[0.85~0.91])。
综上所述,在未接受辅助或新辅助化疗的早期TNBC患者中,TIL水平丰度较高的乳腺癌组织与更好的生存率相关。这些结果表明乳腺组织TIL丰度是早期TNBC患者的预后因素。
高峰科讯
……
1-
4月3日, Developmental Cell :UBE2F对于KRAS突变的人胰腺癌细胞的生长必不可少 [5] 。
研究人员发现UBE2F mRNA在胰腺癌中过表达。高UBE2F水平与更具侵袭性的肿瘤和PDAC患者的生存率较差相关。生物学上,研究人员发现UBE2F敲低抑制了KRAS突变体胰腺癌细胞的生长和生存,但对野生型KRAS胰腺癌细胞没有影响,表明KRAS突变胰腺癌对UBE2F的依赖性作用。
虽然UBE2F在胰腺缺失对小鼠的健康或Cerulein诱导的胰腺炎没有影响,但UBE2F是Cerulein诱导的胰腺炎和KrasG12D-PDAC模型中的肿瘤进展所必需的,因为其缺失抑制了ADM的形成并延缓了mPanINs的进展。考虑到UBE2F单独缺失对KrasG12D诱导的PDAC模型中白细胞、中性粒细胞和巨噬细胞的胰腺浸润没有影响,研究人员得出结论,UBE2F不参与炎症过程,而是在KrasG12D诱导的胰腺肿瘤发生过程中作为Kras-协同的肿瘤进展促进因子。
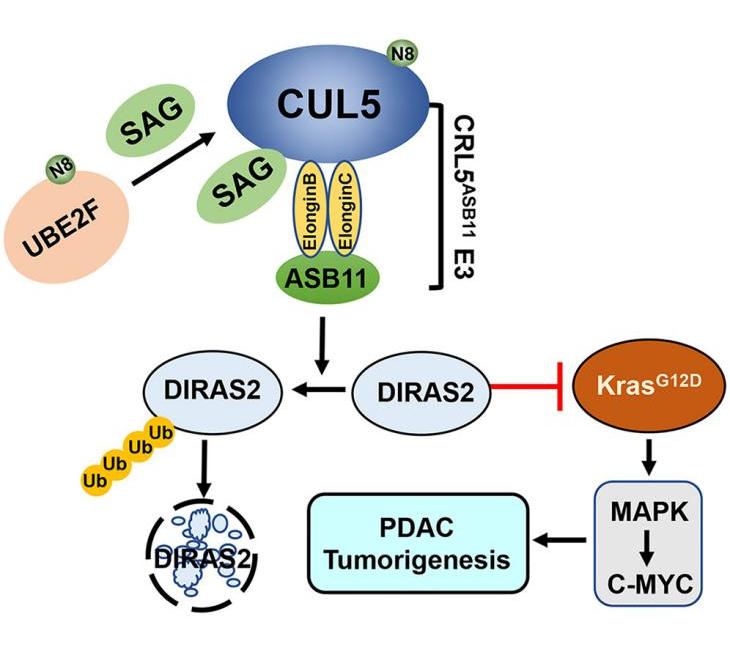
该研究得出UBE2F在体外促进KRAS突变的胰腺癌细胞的生长和存活,以及体内从ADM到mPanINs的肿瘤进展。在机制上,UBE2F与SAG/RBX2偶联以拟素化Cul5激活CRL5,从而泛素化并降解DIRAS2。该研究将ASB11定性为CRL5的底物受体,使DIRAS2失活。该研究发现在KrasG12D PDAC模型中,UBE2F缺失引起了DIRAS2的积累,从而抑制了肿瘤的进展,而DIRAS2缺失则促进了这一过程,并恢复了UBE2F缺失的抑制作用,表明了与UBE2F之间的相互作用。研究发现在胰腺癌组织中,高UBE2F和低DIRAS2水平与较差的患者生存率相关。
综上所述,UBE2F-CRL5ASB11是KRAS突变PDAC的一个有吸引力的药物靶点。
2-
4月8日, Cell Stem Cell :北京大学未来技术学院席建忠教授、上海交通大学附属胸科医院姜丽岩教授和北京大学未来技术学院叶步青教授团队合作,构建了NSCLC患者来源的肿瘤样细胞簇(PTC)模型,并在此基础上进行了化疗药物及免疫疗法的敏感性检测 [6] 。
研究共建立了283个NSCLC患者来源的微肿瘤PTCs模型,成功率为81%,能够在10天内进行100~5000次药物测试。PTCs是由内源性基质细胞、免疫细胞及肿瘤上皮细胞在特定培养条件下自组装而成,在表型和基因型特征上与原始肿瘤表现出高度的相似性,一定程度上模拟了肿瘤的微环境。
利用这些PTCs进行药物敏感性试验,通过前瞻性、双盲、观察性的临床试验结果得出,总体一致性为89%,其中预测CR/PR组与PD组的准确率高达98.1%。此外,该项研究发现通过结合细胞活力和干扰素-γ值评估,PTC模型能够准确预测接受抗PD1治疗患者的临床疗效。
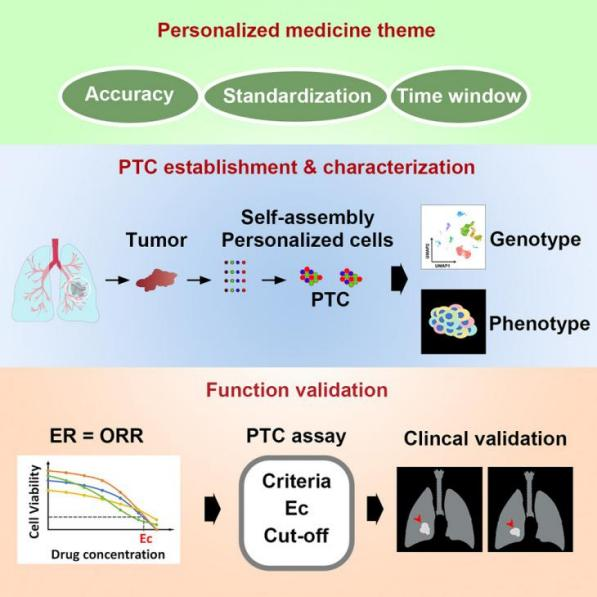
综上所述,PTC可作为非小细胞肺癌个性化治疗和基础研究的有价值的临床前模型。
3-
4月12日, Cell Reports Medicine :天津医科大学于津浦教授、李祥春教授共同通讯阐明了巨噬细胞包被肿瘤簇通过产生局部免疫剥夺加重肝癌侵袭和免疫治疗抵抗 [7] 。
该研究采用先进的高复合体分子谱发现了一种称为巨噬细胞包被肿瘤簇(MCTC)的新型空间结构,它预示着预后差和更具侵袭性的HCC。
巨噬细胞包被肿瘤簇(MCTC)在HCC中具有独特的空间结构组织,与来自3个内部队列和2个独立外部验证队列的572例HCC患者的无复发生存率和总生存率降低相关。从机制上讲,肿瘤源性巨噬细胞相关凝集素Mac-2结合蛋白M2BP诱导MCTC形成,并将免疫能力细胞困在MCTC边缘,诱导肿瘤内细胞毒性T细胞排斥和局部免疫剥夺。
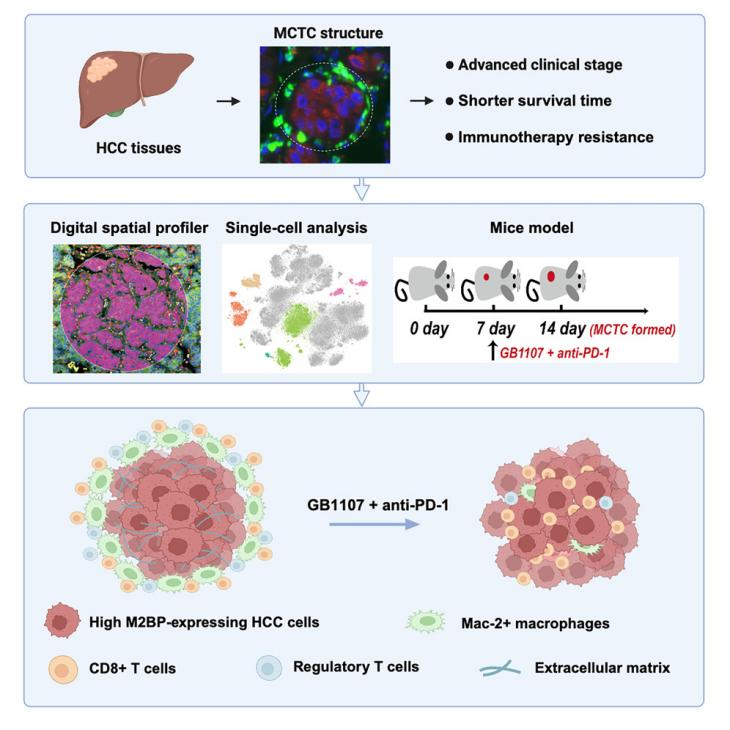
因此,通过使用Mac-2拮抗剂抑制巨噬细胞相关凝集素Mac-2结合蛋白,可以阻止MCTC的形成,恢复T细胞的浸润,为提高HCC中ICI的治疗效果提供了一条有希望的途径。
刊后语
大风泱泱,大潮滂滂;大道如砥,医者无疆。
积跬步以至千里,每一期周刊都是恶性肿瘤学科发展的剪影;积小流以成江海,一年周刊浓缩肿瘤领域各科前沿进展的精华!关注CACA周刊,带你领略恶性肿瘤学科发展的四季花开。
CACA周刊,我们下周不见不散!
编辑 | 李瑞源
排版 | 晓晓
审核 | 李瑞源
链接:http://www.lewenyixue.com/2024/07/02/%E3%80%90CACA%E5%91%A8%E5%88%8A%E3%80%9169%E6%9C%9F%20%E6%94%BE%E7%96%97%E8%AF%B1%E5%AF%BC%E5%89%8D%E8%8D%AF%E6%BF%80%E6%B4%BB/







赶快来坐沙发