代谢助力肿瘤分析,单细胞转录组又添新CP!
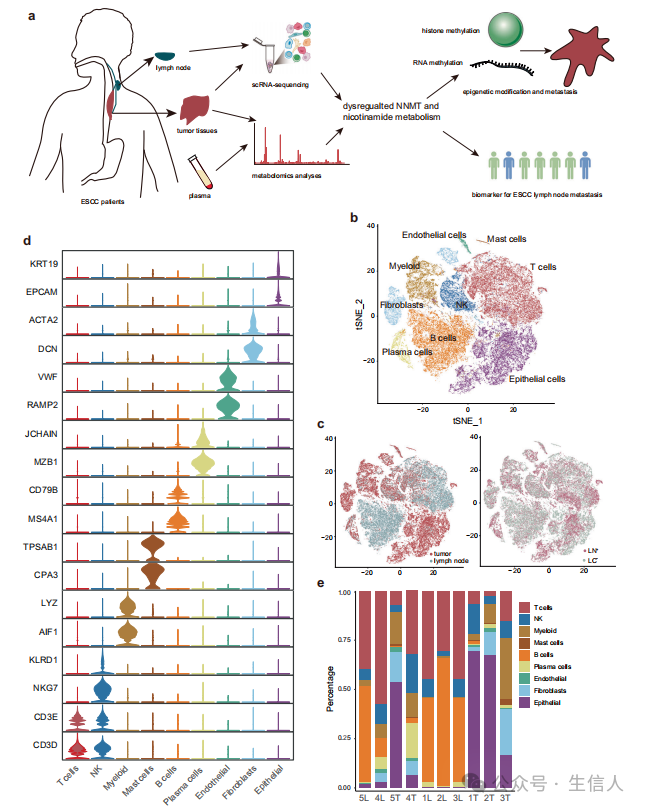
嗨,大家好!今天要给大家介绍的文章题目是Multi−omics analysis reveals NNMT as a master metabolic regulator of metastasis in esophageal squamous cell carcinoma,是一篇今年1月发表在 NPJ Precision Oncology (if:7.9) 杂志上的文章, 本研究对配对的食管鳞癌肿瘤组织和淋巴结进行了scRNA−seq,并在多种细胞类型中观察到异常的细胞代谢。通过对食管鳞癌组织和血浆的代谢组学分析,揭示了食管鳞癌淋巴结转移过程中多种代谢产物和代谢通路的异常。 快来一起看看吧!
食管鳞状细胞癌(ESCC)是食管癌的主要亚型,是世界范围内,尤其是东亚地区常见且致命的癌症。 代谢组学 是一种很有前景的方法,可用于鉴定细胞、组织、生物体液和其他样本的代谢物,这可能为癌症的早期诊断和治疗提供见解。 单细胞RNA测序(scRNA−seq) 可在单细胞水平描绘基因表达网络,从而能够高分辨率地表征各种肿瘤的细胞异质性、发育和分化状态。近年来, 代谢重编程 一直被认为是癌症的一个标志。最近的研究也揭示了恶性细胞的代谢重编程在癌症转移中的重要作用。然而,在食管鳞癌中,恶性细胞的代谢重编程如何影响淋巴结转移尚不清楚。
为了在单细胞水平研究TME的重编程,作者通过scRNA−seq分析了5个食管鳞癌原发肿瘤和5个匹配的淋巴结,其中有(n=2)或无(n=3)转移(图1a−d)。 经过质量控制和去除批次效应,共66,864个细胞涵盖各种恶性和非恶性细胞类型。作者根据标记基因的表达确定了9种主要的细胞类型(图1d)。每种细胞类型的比例在不同样本间差异很大(图1e)。淋巴结转移组(LN+)的髓系细胞、T细胞和浆细胞的相对丰度往往高于非淋巴结转移组(LN−)组。此外,有转移的淋巴结(mLN)中可见上皮细胞,而无转移的淋巴结(nLN)中上皮细胞的相对比例较小。
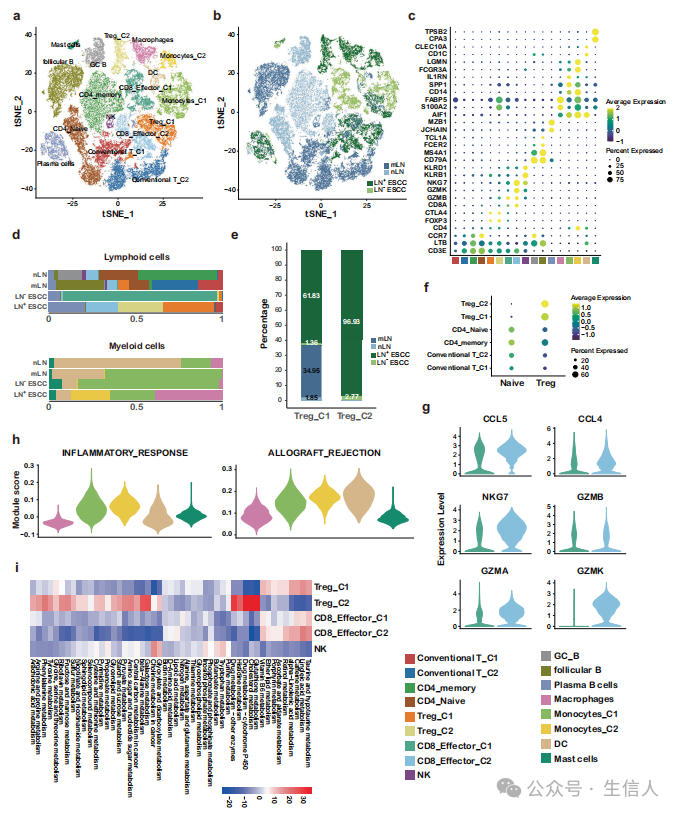
作者根据典型的标记基因(图2c)将淋巴细胞重新聚集,确定了T、NK、B和浆细胞的不同亚型(图2a~e)。 为了研究 CD8+ T细胞和CD4+ T 细胞 中的基因网络,作者使用了公认的naive、Treg和细胞毒性标签,并将这些标签应用于CD8和CD4亚型以及计算出的转录评分(图2f)。在CD8+ T细胞中,CD8_Efftor_C1和CD8_Efftor_C2均表达CCL5、CCL4和效应分子NKG7、GZMA和GZMB,而CD8_Efftor_C2表达GZMK的水平高于CD8_Efftor_C1(图2g),这表明CD8+ T细胞在TIME19的不同状态。对于CD4+ T细胞,Treg形成了两个不同的簇,包括Treg_C1和Treg_C2(图2e, f)。作者发现以FOXP3和CTLA4表达为标记的Treg_C1在LN+ ESCC和mLN中富集(图2e),表明LN+ ESCC中TIME受抑制程度更高。有趣的是,以FABP5高表达为标志的Treg_C2几乎只在LN+ ESCC组织中检测到(96.93%)(图2e)。进一步全面的代谢图谱分析表明,与CD8+ T细胞和NK细胞相比,Treg_C2具有不同的代谢模式。具体而言,一些代谢通路在Treg_C2中高表达。综上所述,LN+ ESCC患者TIME中广泛存在代谢重编程。
本研究发现 B细胞 对肿瘤免疫应答的形成有巨大影响,共分析了7,347个B细胞,确定了3种亚型(图2a)。从nLN、mLN到LN− ESCC和LN+ ESCC,浆B细胞的相对丰度逐步增加(图2d)。基因集变异分析(GSVA)显示,浆B细胞的上皮−间充质转化(EMT)和血管生成上调,提示浆B细胞可能参与了食管鳞癌的淋巴结转移。
作者检测到了5种 髓系细胞 亚型 (图2a)。与其他组织相比,单核细胞C2几乎只在LN+ ESCC中观察到(图2d)。单核细胞C2、单核细胞C1和DC细胞也显示出较高的免疫应答相关标签评分(图2h)。代谢通路基因标签分析显示,一些代谢通路在单核细胞C2中特异上调,进一步证实LN+ ESCC存在代谢重编程。
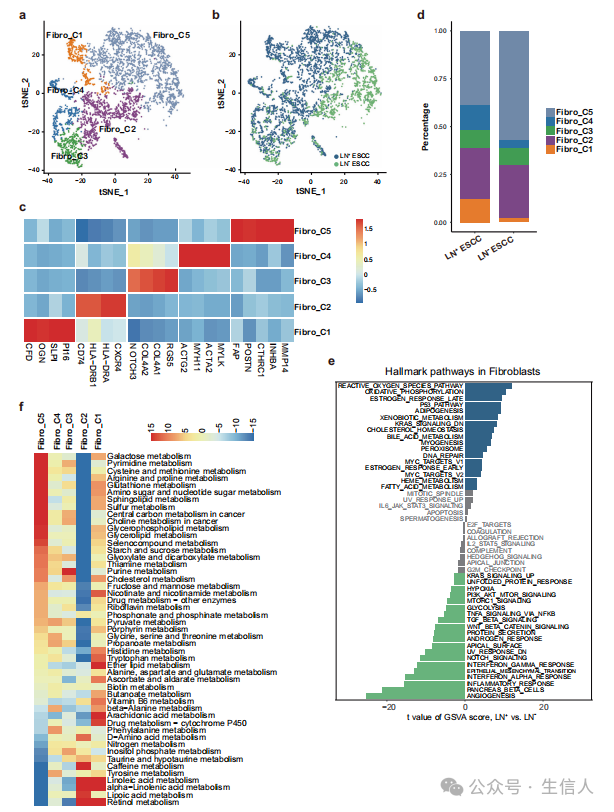
在4151个成纤维细胞中,作者根据标记基因确定了5种成纤维细胞亚型(图3a−c)。 数据表明,LN+组的肌成纤维细胞比LN−组更丰富(图3d),说明肌成纤维细胞可以促进广泛的组织血管生成和肿瘤进展。比较LN+组和LN−组的成纤维细胞发现,LN+组的许多代谢通路显著上调(图3e)。进一步全面的代谢图谱分析表明,CAFs显示出与Fibro_C2细胞相反的代谢模式(图3f),这进一步支持LN+组的代谢组学重编程。
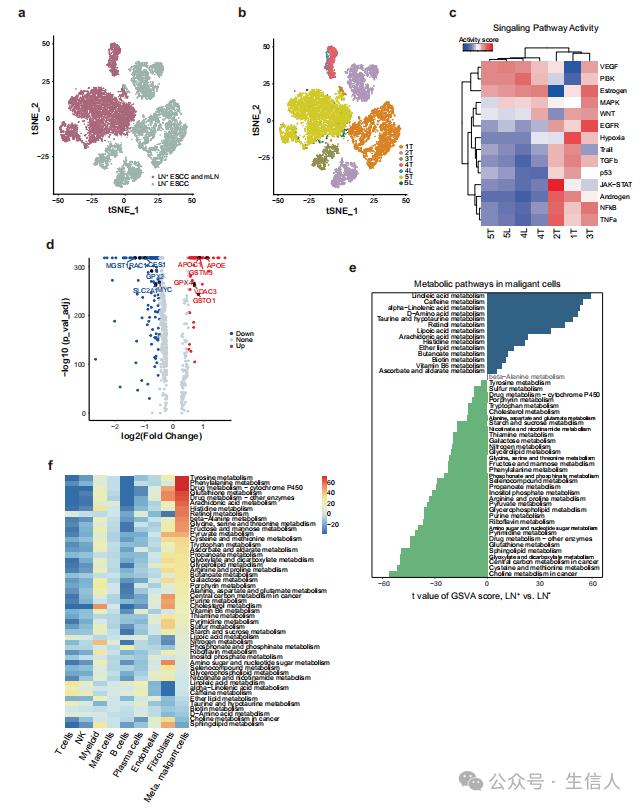
通过分析7个有大于100个上皮细胞的样本的转录组模式(图1e),根据报道的表达谱推断出大规模的拷贝数变异(CNVs)来区分恶性细胞和正常基质细胞和免疫细胞(图4a,b) 。作者定量分析了LN+组和LN−组之间的致癌通路表达,结果显示LN+组的TNFα、TGFβ和NF−kB信号通路活性较高,LN−组的VEGF和PI3K信号通路活性较高(图4c)。对LN+ ESCC和LN− ESCC恶性细胞的直接比较表明,许多差异表达基因(DEGs)参与了代谢相关过程(图4d)。通过分别与LN+组和LN− ESCC内的其他细胞类型进行比较发现LN+组和LN− ESCC组的恶性细胞具有不同的代谢模式(图4e、f)。具体而言,亚油酸代谢和组氨酸代谢在LN+恶性细胞中上调,而谷胱甘肽代谢在LN−恶性细胞中富集(图4e)。综上所述,在淋巴结转移的食管鳞癌中,恶性细胞的代谢广泛失调。
图4 LN+ESCC患者的代谢通路发生了广泛的改变
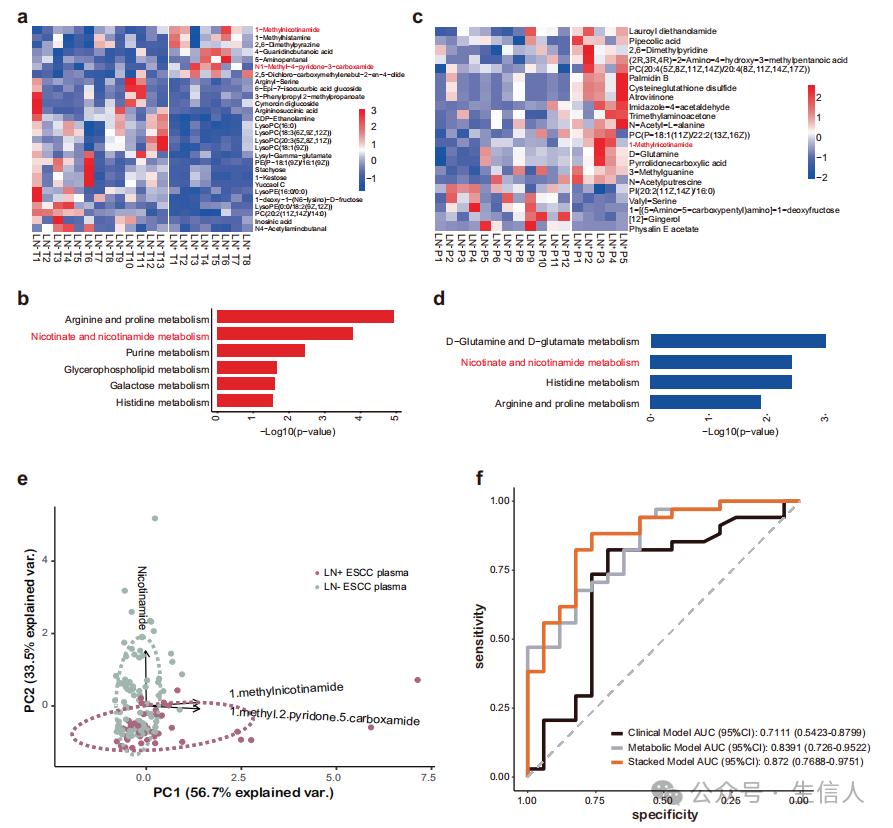
采用非靶向代谢组学方法在代谢物水平直接研究LN+ ESCC的重编程 。对8例LN+和13例LN− ESCC的 肿瘤组织 进行分析(图5a)。通路分析显示,烟酸盐和烟酰胺代谢在LN+ ESCC中高度上调(图5b)。组氨酸代谢也在LN+ ESCC组织中富集(图5b)。引入另一组scRNA−seq数据发现LN+ ESCC恶性细胞的差异表达基因也显著富集于烟酸盐和烟酰胺代谢和通路,进一步证实了ESCC组织的非靶向代谢组学结果。
然后,作者使用非靶向代谢组学检测LN+和LN− ESCC患者的血浆。与LN−ESCC相比,LN+ ESCC患者血浆中1−MNA显著上调(图5c)。通路分析显示,LN+ ESCC中烟酸盐和烟酰胺代谢高度上调,与肿瘤组织样本的代谢组学数据一致(图5d)。组织和血浆的代谢组学数据表明,烟酸和烟酰胺代谢在LN+食管鳞癌中上调。
作者选择烟酰胺、MNA和1−甲基−2−吡啶酮−5−甲酰胺(2−PYR)构建靶向代谢组学检测方法,并在130例食管鳞癌患者队列中测试检测性能。 作者发现基于这3种代谢物可以区分LN+ ESCC和LN− ESCC(图5e,f)。接下来将基于3个筛选出的代谢物的代谢模型与T分期相结合,构建整合模型。发现集成模型在测试集中取得了更好的性能(图5f)。
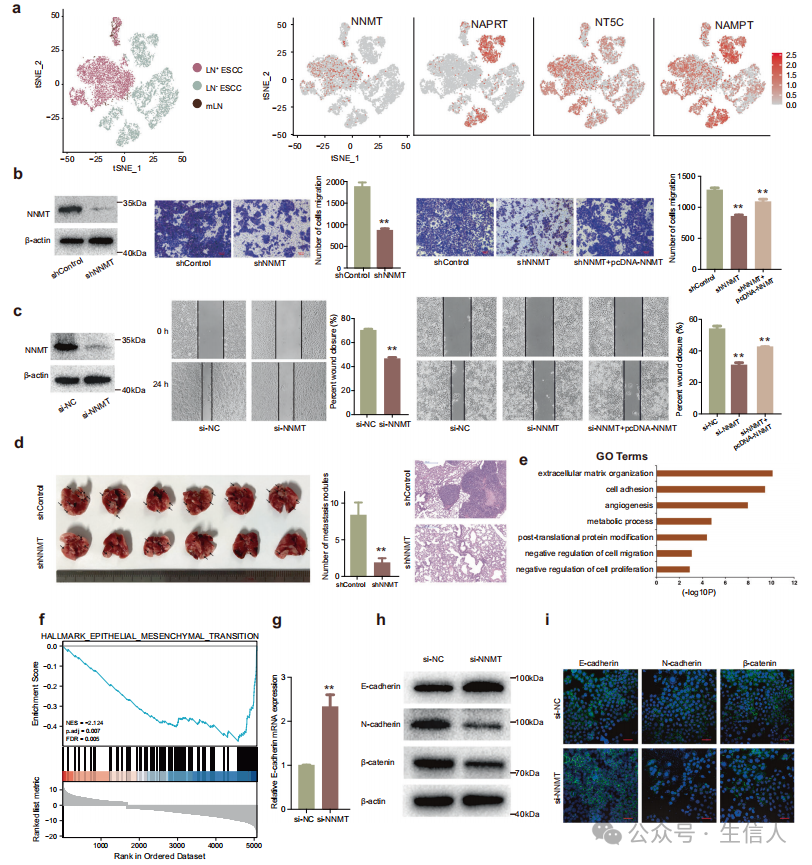
由于来自肿瘤组织和血浆的代谢组学数据均证实LN+ ESCC的烟酸盐和烟酰胺代谢上调,作者探究了其潜在机制 。首先从数据库中检索到烟酸和烟酰胺代谢通路的关键酶。其中,NNMT高表达主要见于LN+ ESCC的恶性细胞中,而在LN− ESCC中几乎不表达(图6a)。NNMT是一种将甲基从S−腺苷甲硫氨酸(SAM)转移到烟酰胺(NA)并产生S−腺苷同型半胱氨酸(SAH)和1−MNA的代谢酶,这与scRNA−seq和代谢组学的发现一致。因此,作者认为在LN+ ESCC中高表达的NNMT有助于烟酸和烟酰胺代谢的重编程。
为了研究NNMT在LN+ ESCC中的生物学作用,作者使用了经过验证的NNMT特异性小干扰RNA (siRNA)序列。Transwell和细胞划痕实验表明,NNMT表达下调可以显著抑制Eca−109细胞的迁移能力(图6b,c)。此外,作者发现NNMT过表达可以部分逆转NNMT敲低介导的迁移抑制(图6b,c,右面板)。为进一步验证NNMT在体内的促进转移作用,将稳定转染sh−NNMT和对照载体的Eca−109细胞尾静脉注射建立小鼠转移模型。与对照组相比,NNMT敲低后肺表面转移结节数量减少(图6d)。
为了明确NNMT的作用机制,并确定ESCC中NNMT的关键下游基因,作者在NNMT敲低后进行了RNA测序。GO分析发现上调最多的生物学过程有细胞外基质组织、细胞黏附、血管生成、代谢过程、翻译后蛋白修饰等(图6e)。此外,基因集富集分析(GSEA)显示与上皮间质转化(EMT)相关的基因集显著富集(图6f)。重要的是,EMT通路的关键基因E−cadherin在NNMT敲低后上调,qRT−PCR验证了这一点(图6g)。此外,western blot和免疫荧光染色实验均证实,敲低NNMT可上调E−cadherin的表达,抑制N−cadherin和β−catenin的表达(图6h,i)。因此,作者认为NNMT可能通过诱导EMT促进食管鳞癌的转移。
7.NNMT通过在转录和转录后水平抑制E−cadherin表达促进食管鳞癌EMT
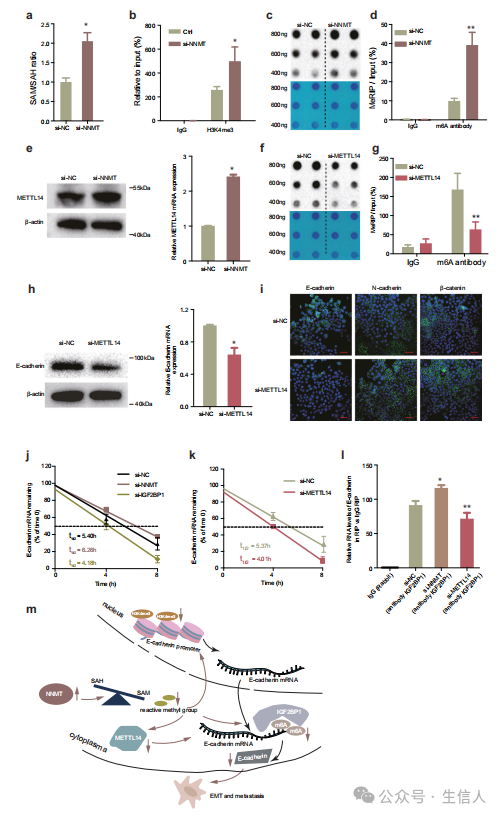
作者通过酶联免疫吸附测定(ELISA)在Eca−109细胞中评估SAM和SAH,发现NNMT敲低确实增加了SAM/SAH的比率(图7a)。先前的研究发现NNMT可以通过影响基因启动子区域的H3K4me3来转录调控基因表达。然后作者使用染色质免疫沉淀(ChIP)检测NNMT是否与E−cadherin启动子区H3K4me3的占据相关。结果表明,E−cadherin启动子富集了内源性H3K4me3,敲低NNMT表达增加了H3K4me3修饰(图7b)。
作者假设NNMT可能通过调控细胞内的甲基群参与m6A修饰,并在转录后水平调控E−cadherin的表达。首先,通过SRAMP分析E−cadherin mRNA序列中m6A修饰位点。发现E−cadherin mRNA中存在许多预测的m6A位点,且具有很高的置信度,表明m6A修饰可能参与了E−cadherin的表达。m6A斑点印迹实验证实NNMT敲低后m6A的总体水平增加,表明NNMT可以影响Eca−109细胞的总体m6A修饰水平(图7c)。结合以上结果,作者推测NNMT可能通过m6A修饰抑制E−cadherin,从而促进食管鳞癌EMT。为了进一步验证NNMT和E−cadherin之间的机制,作者进行了甲基化RNA免疫沉淀−qPCR(MeRIP−qPCR)检测,发现NNMT敲低后,E−cadherin的CDS区m6A水平持续升高(图7d)。因此,作者发现NNMT不仅通过组蛋白修饰方式抑制E−cadherin的表达,而且通过m6A修饰方式抑制E−cadherin的表达。
作者分析了几种甲基转移酶,发现只有METTL14在食管鳞癌中表达下调。因此,作者认为NNMT可能通过与METTL14沟通,以m6A修饰的方式在转录后调控E−cadherin。然后发现,敲低NNMT确实在RNA和蛋白水平上调了METTL14的表达(图7e)。点杂交实验表明,METTL14沉默后,总体m6A水平显著下降(图7f)。METTL14敲低后E−cadherin CDS区m6A水平下调(图7g),敲低METTL14确实可以抑制E−cadherin的表达(图7h)。因此,这些数据表明,METTL14可以通过m6A修饰依赖的方式在转录后水平调节E−cadherin的表达。
为了进一步阐明METTL14在EMT过程中的功能作用,免疫荧光染色检测发现,敲低METTL14抑制E−cadherin的表达,增加N−cadherin和β−catenin的表达(图7i)。为了检测IGF2BP1是否能够识别E−cadherin的m6A修饰,作者使用siRNA敲低IGF2BP1。为了进一步验证NNMT、IGF2BP1和METTL14对E−cadherin RNA稳定性的影响,作者在敲低NNMT、IGF2BP1和METTL14后,用转录抑制剂放线菌素D处理Eca−109细胞。发现敲低NNMT增加了E−cadherin mRNA的半衰期,而敲低IGF2BP1促进了E−cadherin mRNA的降解(图7j)。相反,沉默METTL14后,E−cadherin转录本的半衰期显著降低(图7k)。这些结果表明,E−cadherin mRNA的m6A修饰可以被IGF2BP1识别并结合。RIP实验进一步证实IGF2BP1蛋白可与E−cadherin mRNA直接结合。沉默NNMT后IGF2BP1与E−cadherin mRNA的结合丰度显著增加,而敲低METTL14后IGF2BP1与E−cadherin mRNA的结合丰度被抑制(图7I)。 综上所述,异常的组蛋白修饰和m6A修饰通过NNMT介导的EMT调控,介导E−cadherin表达的抑制,从而促进食管鳞癌的转移(图7m) 。
图7 NNMT通过在转录和转录后水平抑制E−cadherin表达促进食管鳞癌EMT
这篇文章介绍到这里就结束了,小编认为这是一篇非常详细完整的单细胞转录组结合代谢组的文章范文。作者通过scRNA−seq和代谢组学为淋巴结转移的食管鳞癌的代谢重编程提供了证据,通过反复的验证确定了NNMT是连接代谢重编程和表观遗传重构的关键调控因子。本文逻辑清晰、实验设计完整、背靠丰富的背景知识,值得大家学习!
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/07/01/%E4%BB%A3%E8%B0%A2%E5%8A%A9%E5%8A%9B%E8%82%BF%E7%98%A4%E5%88%86%E6%9E%90%EF%BC%8C%E5%8D%95%E7%BB%86%E8%83%9E%E8%BD%AC%E5%BD%95%E7%BB%84%E5%8F%88%E6%B7%BB%E6%96%B0CP/
THE END