《自然·免疫学》:以T细胞变化解释为什么50岁以上人群更易得癌?
或许我们有时候会听到身边的人说这样一句话“50岁是人身体的一道坎”。那你是否曾好奇为什么一定是50岁呢?这个“坎”又会是什么呢?
以下这项研究或许能对你的疑问解答一二。
我们知道伴随机体衰老,其免疫功能会逐步下降。细胞损伤的累积以及持续性炎症等因素都会导致个体患癌的风险升高[1]。免疫系统中尤其是T细胞免疫功能的耗竭与肿瘤失控密切相关。已有的很多研究都局限于关注年轻患者或小鼠的肿瘤微环境,很少考虑不同个体之间年龄差异带来的影响[2-4]。
年老后产生的T细胞与年轻时产生的T细胞是否会有不同?老年身体中的T细胞在患者肿瘤应答过程中发挥了多大的作用?这些信息目前依旧未知,解锁这些信息有助于提升老年癌症患者的预后。
近日,来自 哈佛大学医学院的研究团队在 《 Nature Immunology 》 杂志发表相关研究。 团队研究结果表明老龄的肿瘤微环境中会特别分化出一种年龄相关功能耗竭的CD8 +T细胞(T TAD)。T TAD细胞受到肿瘤微环境中NK-cDC1-CD8 +T细胞的信号轴调控,并与老年患者肿瘤进展相关。使用靶向髓系细胞的CD40激动剂可以减少T TAD细胞的比例,同时增强效应T细胞功能,限制肿瘤进展 。
论文首页信息[5]
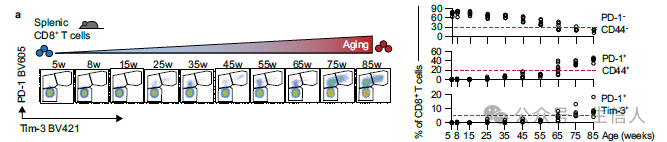
为了将小鼠年龄生长周期与人类进行对应,研究者首先比较了5-85周龄的荷瘤小鼠肿瘤浸润T细胞比例变化,结果表明65-75周龄的小鼠中脾脏内PD-1 +TIM-3 +CD8 +T细胞的比例会有显著的上升。 65-75周龄的小鼠对应人类50-58岁这一段时间,这也是人类中老年患者癌症发病确诊的主要中位时间节点 [6]。
原来不是我们的肌肉不行了,主要是身体内的T细胞在我们50岁的时候一下子“变老了”。
不同周龄的荷瘤小鼠中脾脏T细胞比例变化
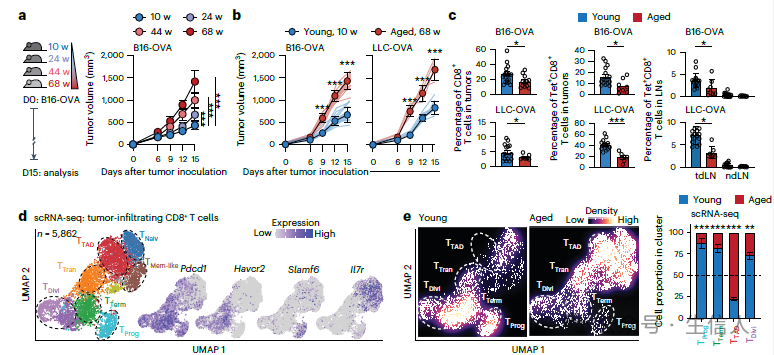
对年轻(10周龄)和老龄(68周龄)小鼠分别注射黑色素瘤细胞(B16-OVA)或肺癌细胞(LLC-OVA)的荷瘤实验结果表明,老龄小鼠体内的肿瘤进展更为迅速且伴随着CD8 +T细胞比例减少。通过单细胞测序分析年轻或老龄小鼠体内肿瘤浸润的CD8 +T细胞, 研究者在老龄小鼠中意外发现一群表达特征为PD-1 + Tox + IL-7R + CD8 + T细胞且不表达 Tcf7,Slamf6 以及 Havcr2 (TIM3) 。 研究者认为该亚群可能是影响老龄小鼠免疫耗竭的关键原因,并将其命名为T TAD 细胞。
老龄小鼠肿瘤微环境中存在独特的T TAD 细胞群
或许你会认为这是鼠里面的结果,人的肿瘤微环境与小鼠的不完全相同,人老了以后体内不一定也有T TAD 细胞。
别着急,接下来研究者就会拿出证据证明 人老了以后的肿瘤微环境中确实也有T TAD细胞 。
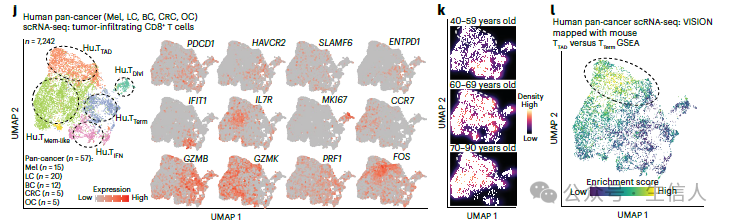
和小鼠中相似,通过对已发表的人类多癌种单细胞测序数据分析,研究者也发现了一群PD-1 +IL-7R +CD8 +T 细胞且不表达 SLAMF6 和 HAVCR2 (TIM-3),并且该细胞群在60岁以上样本中更加富集。将小鼠的T TAD特征基因与人组织中发现的T TAD特征基因进行基因集富集分析(GSEA)映射,结果表明两者高度相关,这不就是同一个T TAD细胞么。
人源泛癌单细胞数据中T TAD 细胞在老年患者肿瘤微环境中富集
既然说T TAD 是一个新的终末耗竭T细胞亚群,那它又有什么独特之处呢?
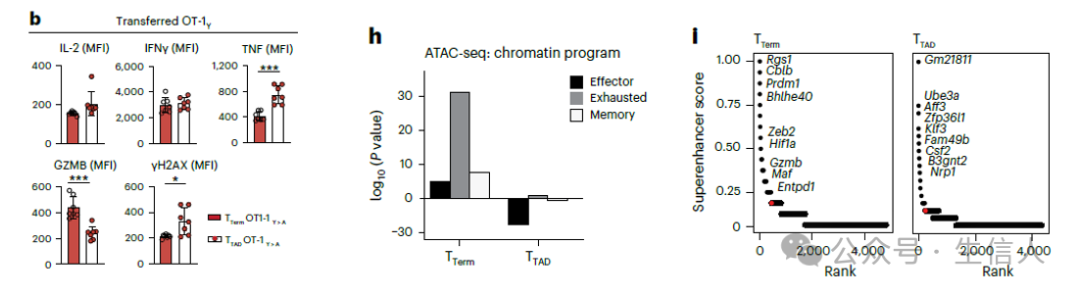
研究者将T TAD细胞群与传统的终末耗竭T细胞(T Term)进行了比较。在增强子启动基因表达方面,T Term细胞表达CD8 +T细胞耗竭相关基因如 Prdm1,Bhlhle40 ,以及 Maf。 而T TAD细胞主要表达的启动子增强基因包括 Zfp36l1,Klf3 ,以及 Fam49b ,这些基因的生物功能主要是限制CD8 +T细胞发挥作用,使其呈现耗竭形态。
在免疫生物功能方面,T Term 细胞与T TAD 细胞具有相似的IFN-γ和IL-2的表达水平,T TAD 细胞会相对分泌更多的TNF和较少的GZMB。
T TAD 细胞是与传统T Term 细胞不同的一群细胞
好吧,我说我怎么不行了,原来是T TAD 细胞的原因!
既然这样,你是否好奇T TAD 细胞在老龄小鼠的肿瘤微环境中是如何出现的呢?是细胞内基因编码的“命运使然”还是其受到细胞外肿瘤微环境中的某种信号诱导调控?
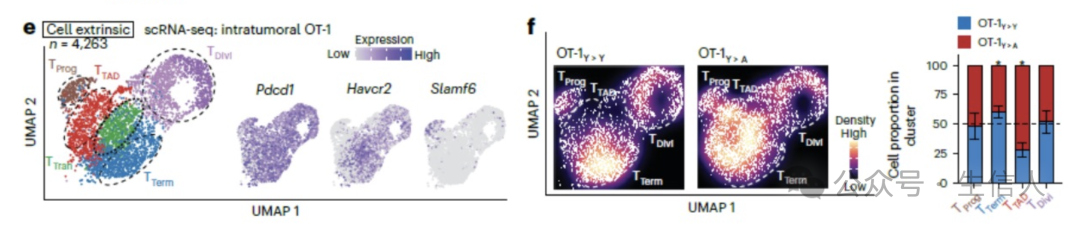
驱动T TAD细胞发育分化的原因是什么呢?研究者分别将年轻(OT-1 Y>Y)或老龄(OT-1 A>Y)小鼠的CD8 +T细胞回输到年轻小鼠体内,以及将年轻(OT-1 Y>A)小鼠的CD8 +T细胞回输到老龄小鼠体内,以此探究不同年龄状态下的肿瘤微环境是否对T TAD细胞的发育产生影响。
有趣的是,回输到年轻小鼠肿瘤微环境中的老龄小鼠来源的CD8 + T(OT-1 A>Y )细胞中并没有T TAD 细胞的出现;然而回输到老龄小鼠肿瘤微环境中年轻小鼠来源的CD8 + T(OT-1 Y>A )细胞中发现了T TAD 细胞。这些由年轻小鼠CD8 + T细胞发育来的T TAD 细胞与老龄小鼠中的T TAD 细胞具有相同的低细胞毒性和终末分化特性。
这些结果说明T TAD 的发育分化主要是由老龄肿瘤微环境中信号调控的结果 。
既然发现是肿瘤微环境中的因素主要影响了T TAD 细胞的发育,那就把它揪出来看看。
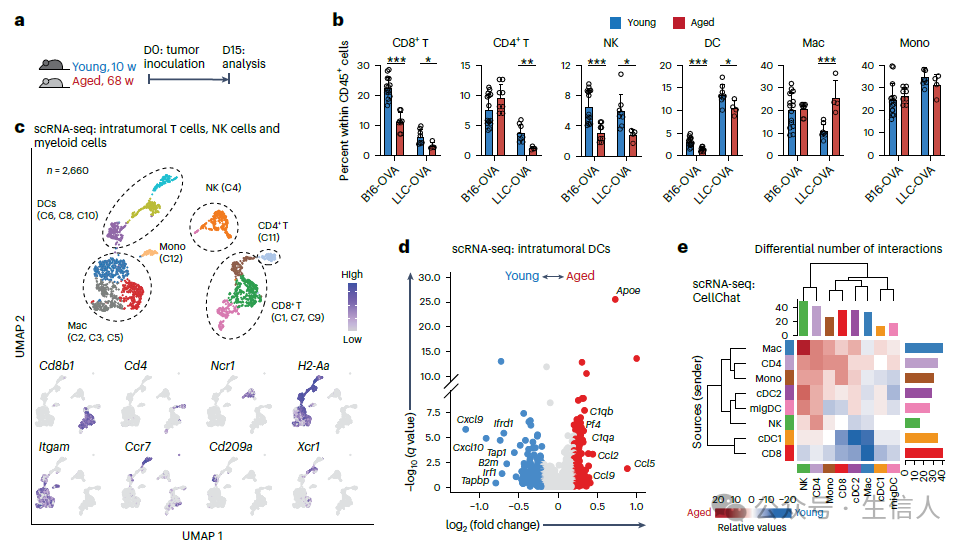
通过比较年轻和老龄荷瘤小鼠的肿瘤微环境中免疫细胞组成, 研究者发现CD8 +T细胞, NK细胞,以及DC细胞的比例在老龄小鼠的肿瘤微环境中显著降低。 因此研究者猜想NK-DC-CD8 +T细胞信号轴在老龄肿瘤微环境中发生了变化,最终影响了CD8 +T细胞的发育分化。
研究者发现在年老的小鼠肿瘤微环境中抗原递呈能力明显降低,尤其是DC细胞的抗原呈递相关基因表达如 B2m 和 Tap1 显著降低,同时会上调表达抑制抗原呈递的相关基因如 Apoe。
顺藤摸瓜,最终研究者 在老龄的小鼠肿瘤微环境中观察到主要是NK细胞与cDC1细胞之间XCL1-XCR1信号交流的缺乏致使cDC1对CD8 +T细胞的抗原呈递能力下降,使得CD8 +T细胞的免疫功能受到影响,促进了T TAD细胞的发育并间接影响了其对肿瘤增长的控制 。
老龄小鼠肿瘤微环境中NK-cDC1-CD8 + T细胞信号交流受到干扰
因此,在NK-cDC1-CD8 + T细胞信号轴中CD8 + T细胞的抗原呈递直接影响着CD8 + T细胞功能,cDC1细胞在这一环中具有核心调控作用。那能否通过针对cDC1细胞来改善老龄肿瘤微环境的免疫应答状态?
CD40激动剂可以在肿瘤环境中有效增加髓系细胞数量从而提升其功能[7]。
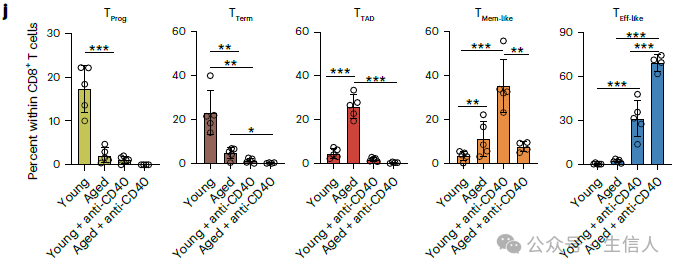
研究者对年轻及老龄荷瘤小鼠进行了CD40激动剂给药治疗。治疗后的结果显示cDC1细胞的比例明显升高;包括T prog细胞,T Term细胞,以及T TAD细胞在内的终末耗竭T细胞比例明显减少;与此平行出现的是记忆性T Mem-like和效应T Eff-like的比例显著增加。 这些现象共同表明CD40激动剂有效的改善了肿瘤微环境的免疫状态 。
CD40激动剂可以有效改善老龄肿瘤微环境免疫耗竭状态
总而言之,研究者首次发现了年龄相关功能耗竭的CD8 + T (T TAD )细胞,揭示了其在老龄肿瘤微环境中的具体作用并提供了相应的治疗手段。T TAD 细胞的出现即是机体衰老后的细胞内在编码所决定,更重要的还是衰老后的肿瘤微环境调控影响。
针对实体瘤的免疫治疗低效性一直是临床研究中的重点攻克方向,T TAD 细胞这一概念或许能提示临床科研人员更加重视不同年龄患者之间的肿瘤环境差异,进而提供更加有效的个性化治疗策略。
参考文献
[1] BERBEN L, FLORIS G, WILDIERS H, et al. Cancer and Aging: Two Tightly Interconnected Biological Processes [J]. Cancers (Basel), 2021, 13(6).
[2] GORONZY J J, WEYAND C M. Successful and Maladaptive T Cell Aging [J]. Immunity, 2017, 46(3): 364-78.
[3] MOSKOWITZ D M, ZHANG D W, HU B, et al. Epigenomics of human CD8 T cell differentiation and aging [J]. Sci Immunol, 2017, 2(8).
[4] PEREIRA B I, DE MAEYER R P H, COVRE L P, et al. Sestrins induce natural killer function in senescent-like CD8(+) T cells [J]. Nat Immunol, 2020, 21(6): 684-94.
[5]CHEN A C Y, JAISWAL S, MARTINEZ D, et al. The aged tumor microenvironment limits T cell control of cancer [J]. Nat Immunol, 2024.
[6] DUTTA S, SENGUPTA P. Men and mice: Relating their ages [J]. Life Sci, 2016, 152: 244-8.
[7] VONDERHEIDE R H. CD40 Agonist Antibodies in Cancer Immunotherapy [J]. Annu Rev Med, 2020, 71: 47-58.
链接:http://www.lewenyixue.com/2024/07/01/%E3%80%8A%E8%87%AA%E7%84%B6%C2%B7%E5%85%8D%E7%96%AB%E5%AD%A6%E3%80%8B%EF%BC%9A%E4%BB%A5T%E7%BB%86%E8%83%9E%E5%8F%98%E5%8C%96%E8%A7%A3%E9%87%8A%E4%B8%BA%E4%BB%80%E4%B9%88/






赶快来坐沙发