转录失调是癌症的关键因素,通常源于转录因子或表观遗传调节因子的突变和/或过度表达。这种失调会导致癌症细胞变得高度依赖某些转录调节因子,从而维持其恶性表型和细胞身份。神经母细胞瘤(NB)是一种起源于交感神经系统的异质性实体瘤,其特征是遗传事件和表观遗传扰动,这在很大程度上取决于几种关键癌基因和驱动/抑制基因的相互作用。一群NB关键转录因子的表达失调,包括PHOX2B、HAND2、MYCN、MEIS2等,通过破坏细胞增殖和分化之间的微妙平衡,导致肾上腺素能型NB的启动和进展。
超级增强子(SE)作为高活性调节元件,通常表现出比典型增强子(TE)更高的组织特异性,能够驱动更高水平的基因转录。癌症细胞在关键癌基因和其他调节因子处产生SE,从而增强基因表达谱转录,这一概念在癌症生物学领域中被广泛接受。 因此,探索癌症中SE驱动的关键基因,为缺乏明确已知遗传驱动因素的癌症的靶点发现提供了思路。
近日, 苏州大学附属儿童医院潘健和张子木团队 在 Neuro-Oncology 上发表题为 Super-enhancer-driven IRF2BP2 enhances ALK activity and promotes neuroblastoma cell proliferation 的文章, 鉴定出一个由NB主转录因子簇MYCN, MEIS2和HAND2 调节激活的新SE区域,导致靶基因IRF2BP2的异常高表达。IRF2BP2能够与该NB主转录因子簇之间形成正反馈回路,从而在NB中建立稳定持续的高水平IRF2BP2的表达。此外,IRF2BP2还能够与先驱因子AP-1家族成员通过调节NB易感基因ALK的染色质可及性,维持NB细胞增殖与存活。这项研究为NB生物学提供了新的见解,并有可能为NB下调ALK提供替代策略。
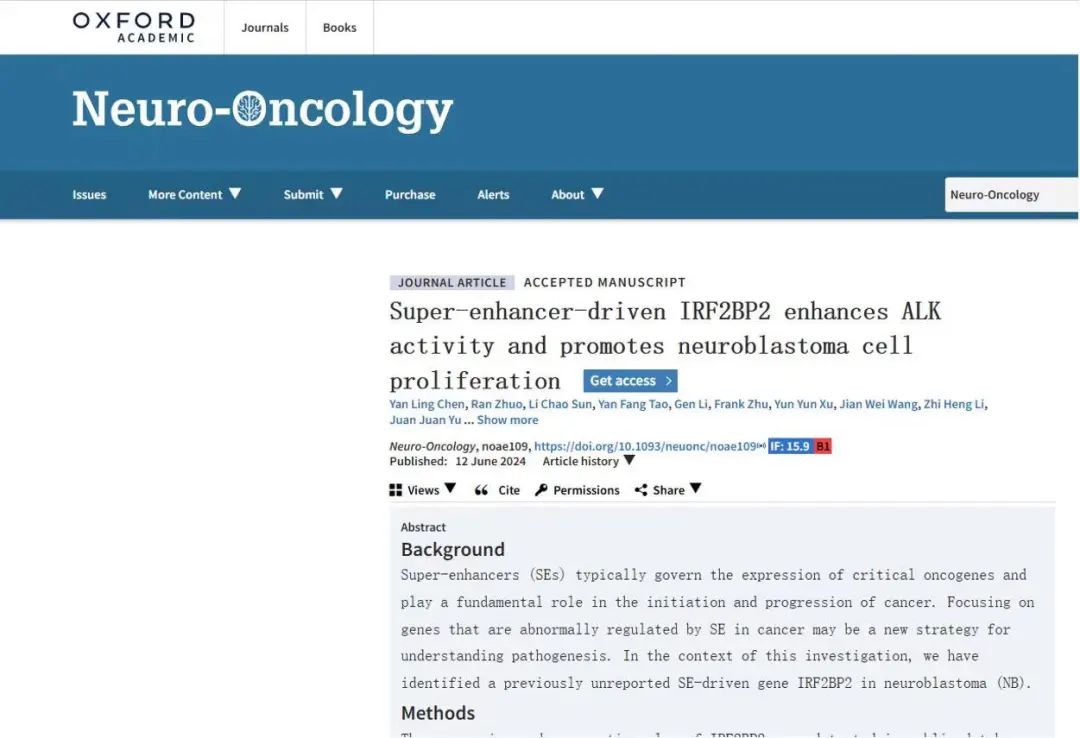
首先,研究人员通过ROSE算法对H3K27ac ChIP-seq读值进行分类并确定密度阈值的方法,揭示了先前报道的33例NB临床样本和NB细胞株中的SE景观。 通过H3K27ac-HiChIP分析鉴别出NB中出现频率最高的候选SE区域之一(chr1:234598806-234615169)与IRF2BP2启动子之间发生三维互作。 NB公开数据库和组织微阵列结果表明,与正常外周神经组织相比,IRF2BP2在NB中异常高表达并与肿瘤不良预后相关。双荧光素酶报告实验验证表明,该SE中组分增强子E3表现出强大的报告基因活性。利用CRISPR/dCas9技术靶向E3的sgRNA显著降低了该组分增强子元件上的H3K27ac修饰,并导致IRF2BP2在转录水平和蛋白质水平上的表达下降。
 IRF2BP2在神经母细胞瘤中受SE调控
IRF2BP2在神经母细胞瘤中受SE调控
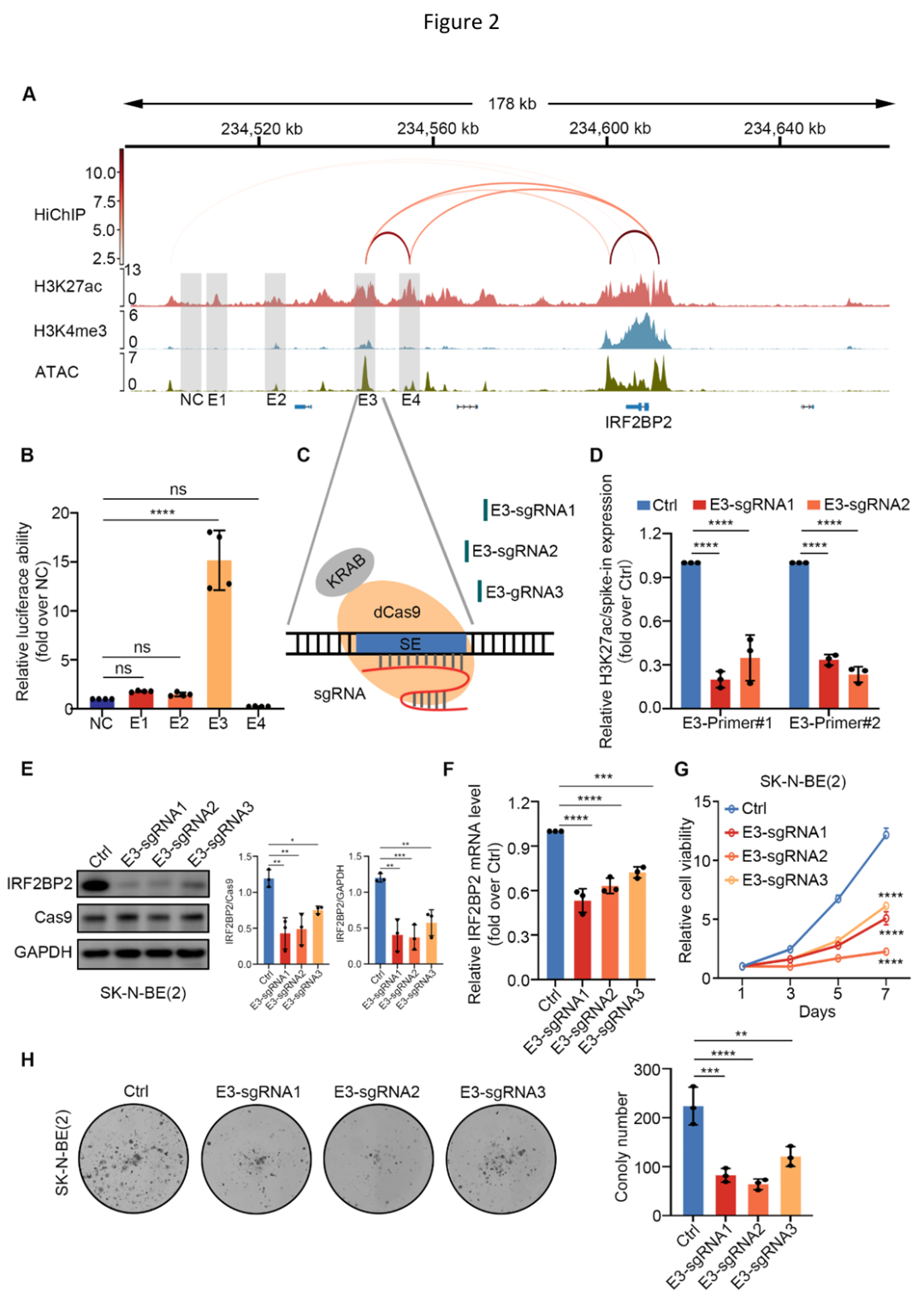
通过分析维持NB肾上腺素能型身份的7个主转录因子(包括MYCN、HAND2、MEIS2、PHOX2B、ISL1、GATA3和TBX2)CUT&Tag结果,研究人员进一步发现IRF2BP2-SE区域中的E2和E3组分增强子包含所有这些TF的结合位点,并表现出很强的结合活性,且与高水平H3K27ac标记的区域相一致。此外,R2数据库分析显示这些主转录因子的表达与IRF2BP2表达之间均呈强烈正相关。
随后,研究人员通过CUT&RUN qPCR、双荧光素酶报告实验等验证了主转录因子中的HAND2、MYCN和MEIS2可以结合并显著激活IRF2BP2-SE区域内的组分增强子E3,从而提高IRF2BP2的转录水平。
NB 主 TF簇(HAND2、MYCN 和 MEIS2)协同激活 IRF2BP2-SE
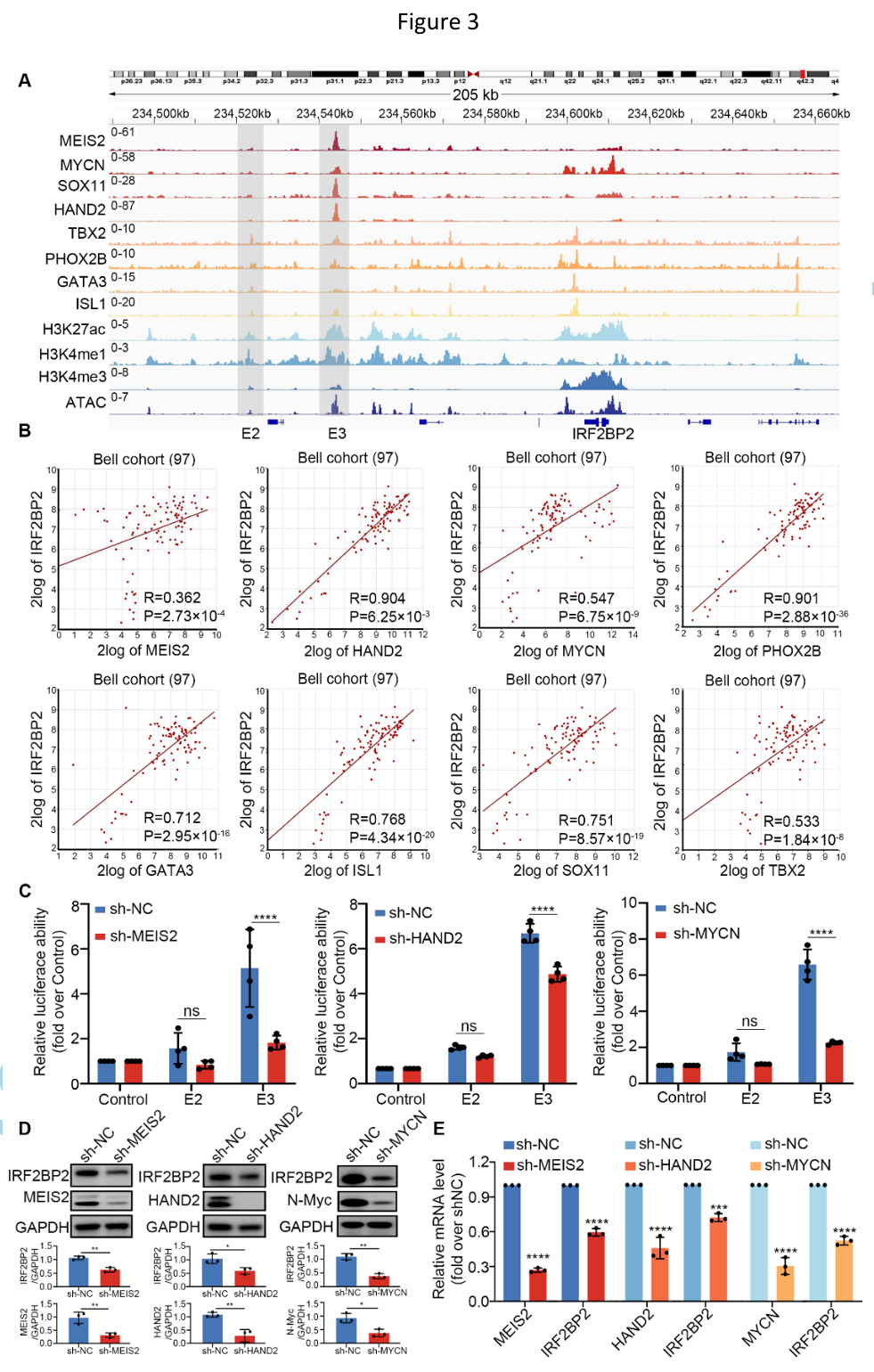
相应地,RNA-seq分析结果表明SK-N-BE(2)肾上腺素能型身份基因在IRF2BP2缺失后被显著抑制、SK-N-BE(2)丢失肾上腺素能亚型身份。更令人感兴趣的是,研究人员对在NB细胞中IRF2BP2干扰后与IRF2BP2启动子结合并表达下调的基因进行EnrichR富集分析,结果显示除细胞迁移、血管黏附和血管生成等通路的富集外,MYCN、HAND2、MEIS2共表达途径也被显著富集。CUT&Tag IGV可视化结果显示,IRF2BP2、MYCN、HAND2和MEIS2在其各自的SE元件和其他原件上显著共占有,表现出共结合模式。同时,Western blot实验及基于酵母双杂交系统的荧光素酶报告基因测定表明IRF2BP2正向调控MEIS2、HAND2和MYCN的表达。
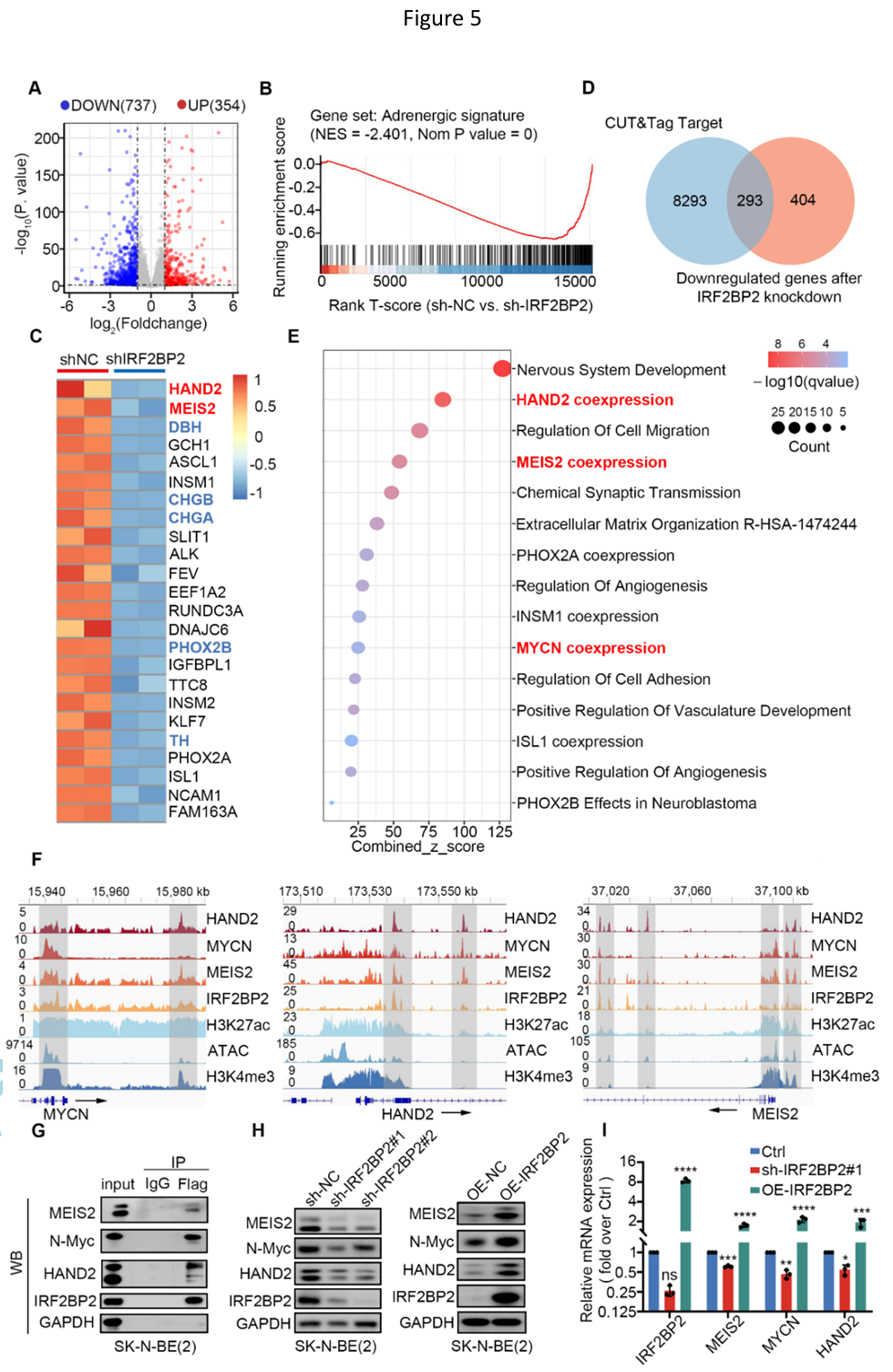
主转录因子簇与IRF2BP2形成复合物协同调节NB重要肾上腺素能身份基因的表达
此外,通过Homer工具对转录辅因子IRF2BP2 CUT&Tag结果进行的Motif富集分析显示,IRF2BP2结合峰内AP-1家族成员结合位点显著富集。基于先驱因子AP-1家族在癌症细胞中染色质重塑和染色质可及性维持的重要性,以及IRF2BP2扰动后SK-N-BE(2)细胞内IRF2BP2结合区域的ATAC峰显著降低,研究人员推断IRF2BP2/AP-1协同调控NB中重要癌基因的染色质可及性景观。随后,进一步将IRF2BP2结合峰与变化的开放染色质区域及转录水平差异表达基因进行了交叉参考,并鉴定出24个重叠基因,被定义为AP-1依赖性IRF2BP2靶基因。其中,家族性NB易感基因ALK,在IRF2BP2/AP-1结合位点区域的ATAC峰会随着IRF2BP2的缺失显著降低,进而导致ALK表达抑制。这些结果表明,在NB细胞中,AP-1协同IRF2BP2塑造了独特的染色质可及性景观,从而协同诱导易感基因ALK的表达。
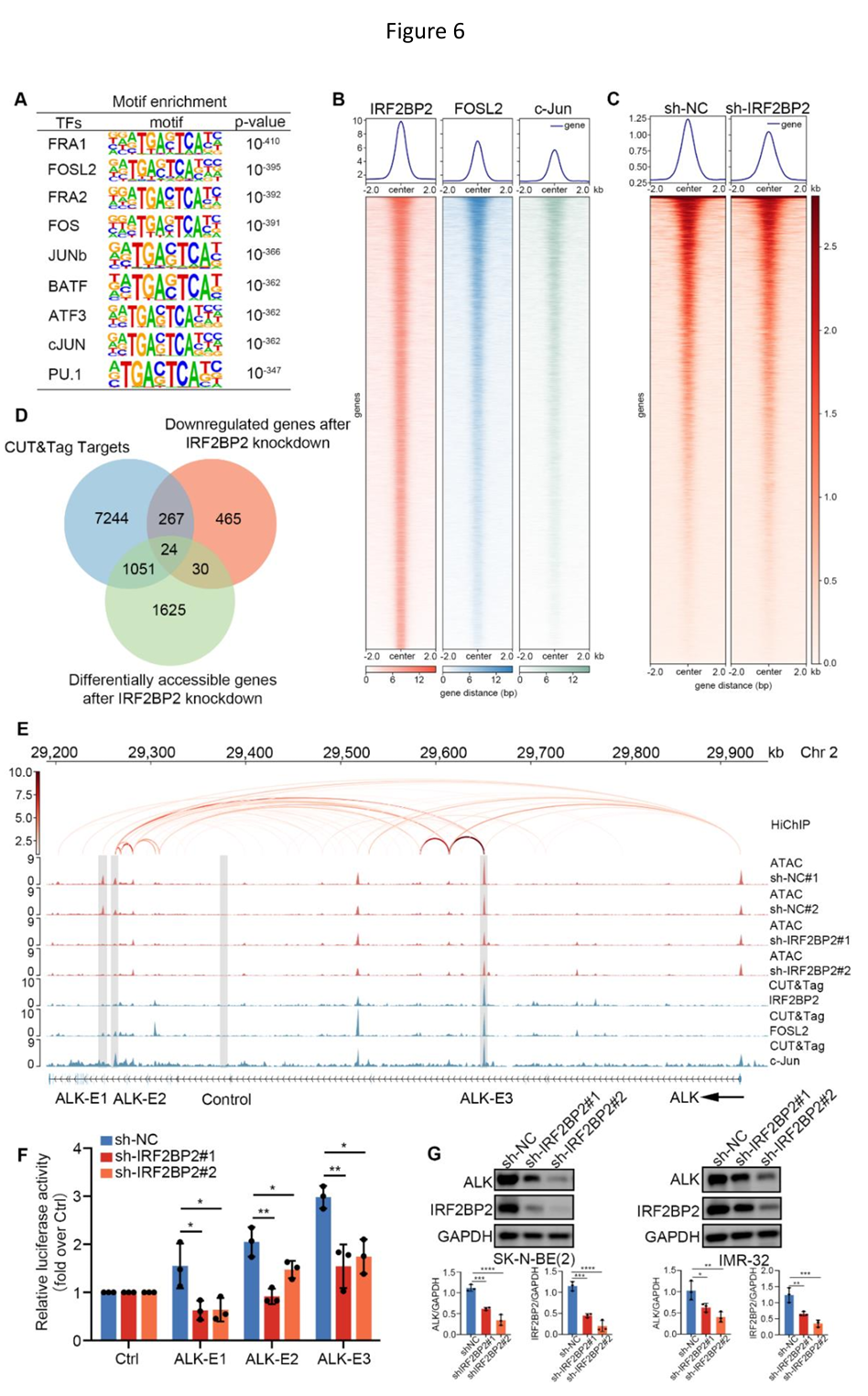
IRF2BP2/AP-1调节NB易感基因ALK的染色质可及性从而影响其转录水平
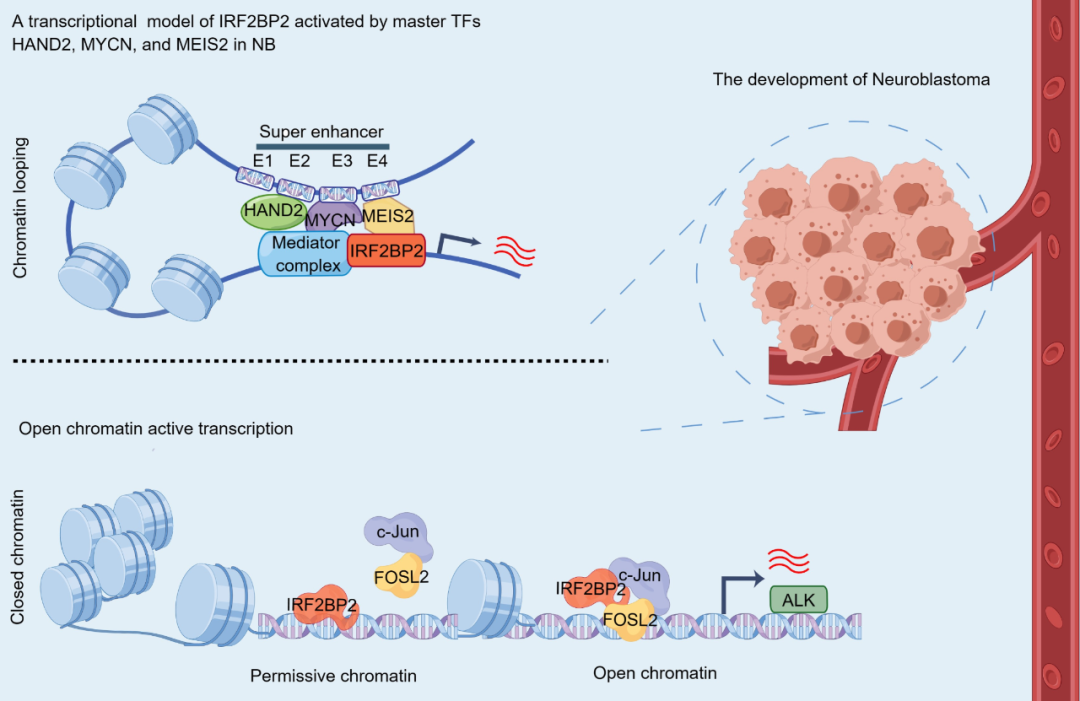
SE驱动基因IRF2BP2介导NB肿瘤发生发展的调节机制示意图
综上所述,这项研究首次提供了受SE驱动的IRF2BP2在NB中发挥重要致癌作用的证据。 文章表明,NB特异性主转录因子簇激活SE,维持高IRF2BP2表达并形成正反馈环路、协同调节NB细胞增殖。提示破坏这些特定的分子相互作用,阻止NB的高度增殖,是靶向干预或治疗肾上腺素能型NB的新思路。此外,通过揭示涉及IRF2BP2/AP-1对染色质可及性的调控机制,这项研究为NB靶向易感基因ALK的治疗提供了潜在替代策略。
苏州大学附属儿童医院儿科临床研究所潘健研究员和张子木副研究员为本文通讯作者,陈雁玲、卓然、孙力超、陶燕芳、李根为共同第一作者。
撰文

责编

制作
排版 | Sheila 校对 | uu
延伸阅读
帕博西尼显著提高神经母细胞瘤分化,有望改善现有疗法
*本文由深圳市拾玉儿童公益基金会“儿童肿瘤前沿”团队编译或约稿,文中图表均源引自文献原文。本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。如需转载,请留言或联系shiyu@curekids.cn。本文旨在分享儿童肿瘤科研前沿成果,不是治疗方案推荐。如需获得疾病治疗方案指导,请前往正规医院就诊。
▼滑动查看更多▼
Background:Super-enhancers (SEs) typically govern the expression of critical oncogenes and play a fundamental role in the initiation and progression of cancer. Focusing on genes that are abnormally regulated by SE in cancer may be a new strategy for understanding pathogenesis. In the context of this investigation, we have identified a previously unreported SE-driven gene IRF2BP2 in neuroblastoma (NB).
Methods:The expression and prognostic value of IRF2BP2 were detected in public databases and clinical samples. The effect of IRF2BP2 on NB cell growth and apoptosis was evaluated through in vivo and in vitro functional loss experiments. The molecular mechanism of IRF2BP2 was investigated by the study of chromatin regulatory regions and transcriptome sequencing.
Results:The sustained high expression of IRF2BP2 results from the activation of a novel SE established by NB master transcription factors MYCN, MEIS2 and HAND2, and they form a new complex that regulates the gene network associated with the proliferation of NB cell populations. We also observed a significant enrichment of the AP-1 family at the binding sites of IRF2BP2. Remarkably, within NB cells, AP-1 plays a pivotal role in shaping the chromatin accessibility landscape, thereby exposing the binding site for IRF2BP2. This orchestrated action enables AP-1 and IRF2BP2 to collaboratively stimulate the expression of the NB susceptibility gene ALK, thereby upholding the highly proliferative phenotype characteristic of NB.
Conclusion:Our findings indicate that SE-driven IRF2BP2 can bind to AP-1 to maintain the survival of tumor cells via regulating chromatin accessibility of NB susceptibility gene ALK.
DOI: 10.1093/neuonc/noae109
 点击此处,直达原文
点击此处,直达原文
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/06/30/Neuro-Oncology%20%7C%20%E8%8B%8F%E5%B7%9E%E5%84%BF/
 点击此处,直达原文
点击此处,直达原文 











 未来|指南共识|广东省药学会发布《医疗机构药品费用科学管理(DES)专家共识》
未来|指南共识|广东省药学会发布《医疗机构药品费用科学管理(DES)专家共识》
赶快来坐沙发