Science | 蛋白激酶ERK调控的磷酸化蛋白质组驱动KRAS突变癌症
撰文: Even
IF=56.9
推荐度: 
亮点:
-
1、 系统性地评估 ERK 调控磷酸化蛋白与 KRAS 突变肿瘤细胞生长依赖性的关系。
-
2、ERK 在细胞核和细胞质中都有关键调控功能,影响多个重要生物学过程。
-
3、鉴定出 KRAS 特异性依赖的 ERK 调控关键基因,为靶向 KRAS 信号通路提供新的线索。
在癌症中发现 KRAS 突变近 40 年后,临床有效的 KRAS 抑制剂已被批准用于 KRAS G12C 突变的非小细胞肺癌。然而,只有 <50% 的患者最初有反应,大多数有反应的患者在 6 个月内产生耐药性并复发。
来自复发患者的肿瘤和循环肿瘤 DNA (ctDNA) 的测序鉴定出 RAS 信号网络中导致 ERK MAPK 信号重新激活的组分的突变激活或失活。尽管大量的质谱分析已经确定了 ERK1/2 的直接或间接底物,但不同研究之间有限的重叠表明, ERK 依赖性磷酸化事件尚未阐明。
2024 年 6 月 7 日,北卡罗来纳大学 Clint A. Stalnecker 团队在 Science 上发表题为 : Determining the ERK-regulated phosphoproteomedriving KRAS-mutant cancer 的研究性论文。
该研究测定了 KRAS 突变型胰腺癌中 ERK 依赖性磷酸化蛋白组。 ERK1 和 ERK2 具有几乎相同的信号传导和转化输出, KRAS 调节的磷酸化蛋白质组几乎完全由 ERK 驱动。作者在鉴定了 4666 个 ERK 依赖性磷酸化位点,其中分别有 79% 和 66% 以前与 ERK 无关,这大大扩展了 ERK 依赖性磷酸化事件的深度和广度,并揭示了 ERK 在癌症中的更复杂的功能。
研究确定 ERK 控制着一个高度动态和复杂的磷酸化蛋白质组,该蛋白质组集中于细胞周期蛋白依赖性激酶调节和 RAS 同源鸟苷三磷酸酶功能 (RHO GTPase) 。本研究的研究结果建立了最全面的分子图谱和 ERK 驱动 KRAS 依赖性胰腺癌生长的机制。
KRAS 激活是胰腺导管腺癌 (PDAC) 生长的主要遗传驱动因素。活化的 RAF 进而磷酸化并激活 MEK1/2, 进而磷酸化激活 ERK1/2 。然而 RAF 和 MEK 对底物的利用受到高度限制。 ERK 的底物利用范围广泛多样 , 但 ERK 如何驱动 KRAS 突变的癌症生长仍然知之甚少。
作者构建了持续活化的 ERK1(ERK1SD) 和 ERK2(ERK2SD) 变异体,并在 KRAS 突变的胰腺导管腺癌 (PDAC) 细胞系中表达。结果发现,单独的活化 ERK1 或 ERK2 就足以维持 KRAS 依赖的 PDAC 生长,两种 ERK 亚型在此过程中显示出功能上的冗余性。
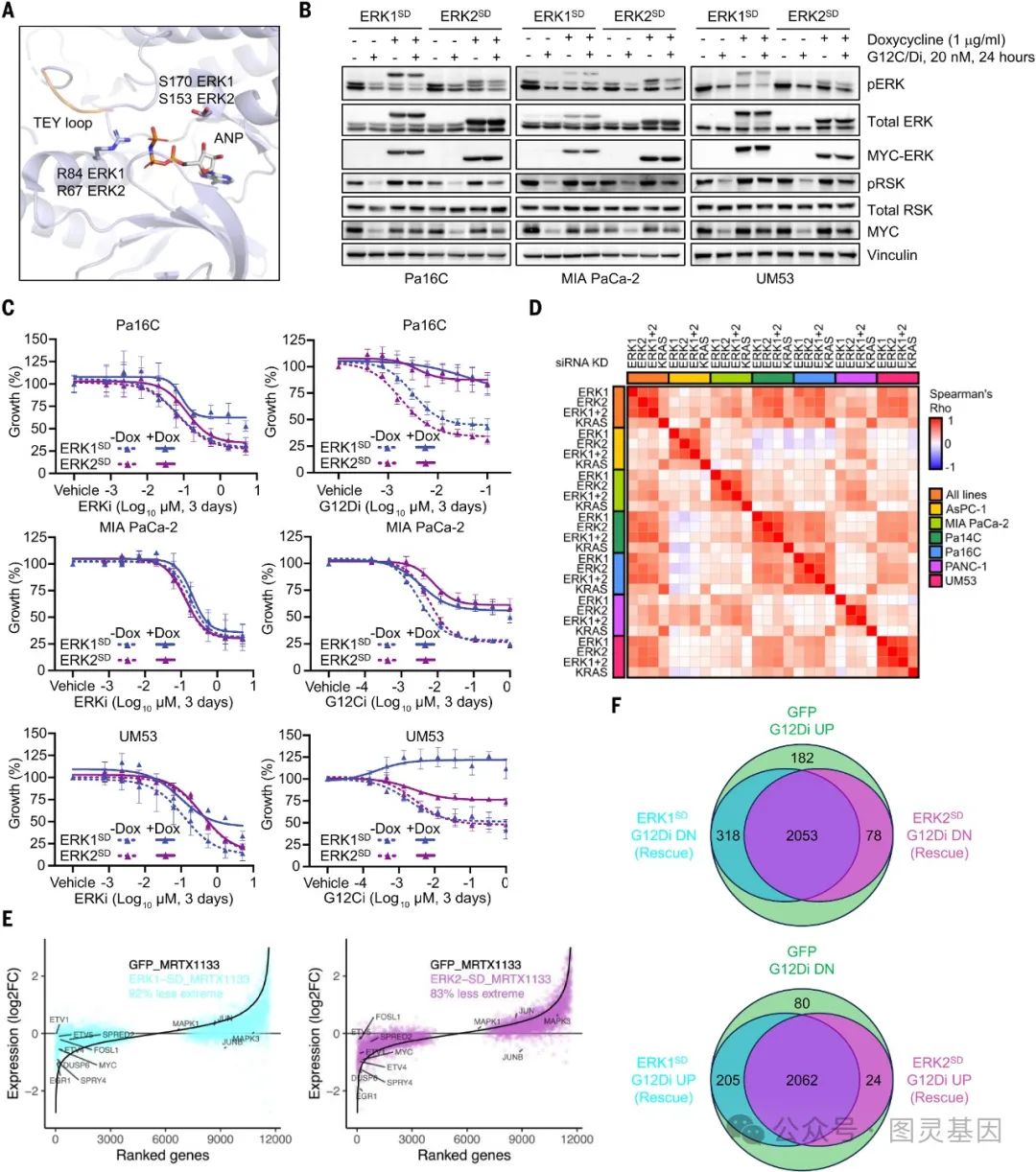
1 、 ERK1 和 ERK2 支持 KRAS 依赖性生长
图 1. ERK 信号对于 KRAS 调控的 PDAC 生长至关重要
作者构建了持续活化的 ERK1(ERK1SD) 和 ERK2(ERK2SD) 变异体,并在 KRAS 突变的胰腺导管腺癌 (PDAC) 细胞系中表达。结果发现,单独表达 ERK1SD 或 ERK2SD 就能使这些 PDAC 细胞对 KRAS 选择性抑制剂 (G12Ci 和 G12Di) 产生耐药。单独敲低任一 ERK 亚型都会显著抑制 PDAC 细胞生长,与敲低 KRAS 本身的效果相当。抑制 ERK1 和 ERK2 所诱导的信号变化高度相关。过表达 ERK1SD 或 ERK2SD 能够抑制 KRAS 选择性抑制剂诱导的大部分转录变化。综上所述,单独的活化 ERK1 或 ERK2 就足以维持 KRAS 依赖的 PDAC 生长,两种 ERK 亚型在此过程中显示出功能上的冗余性。
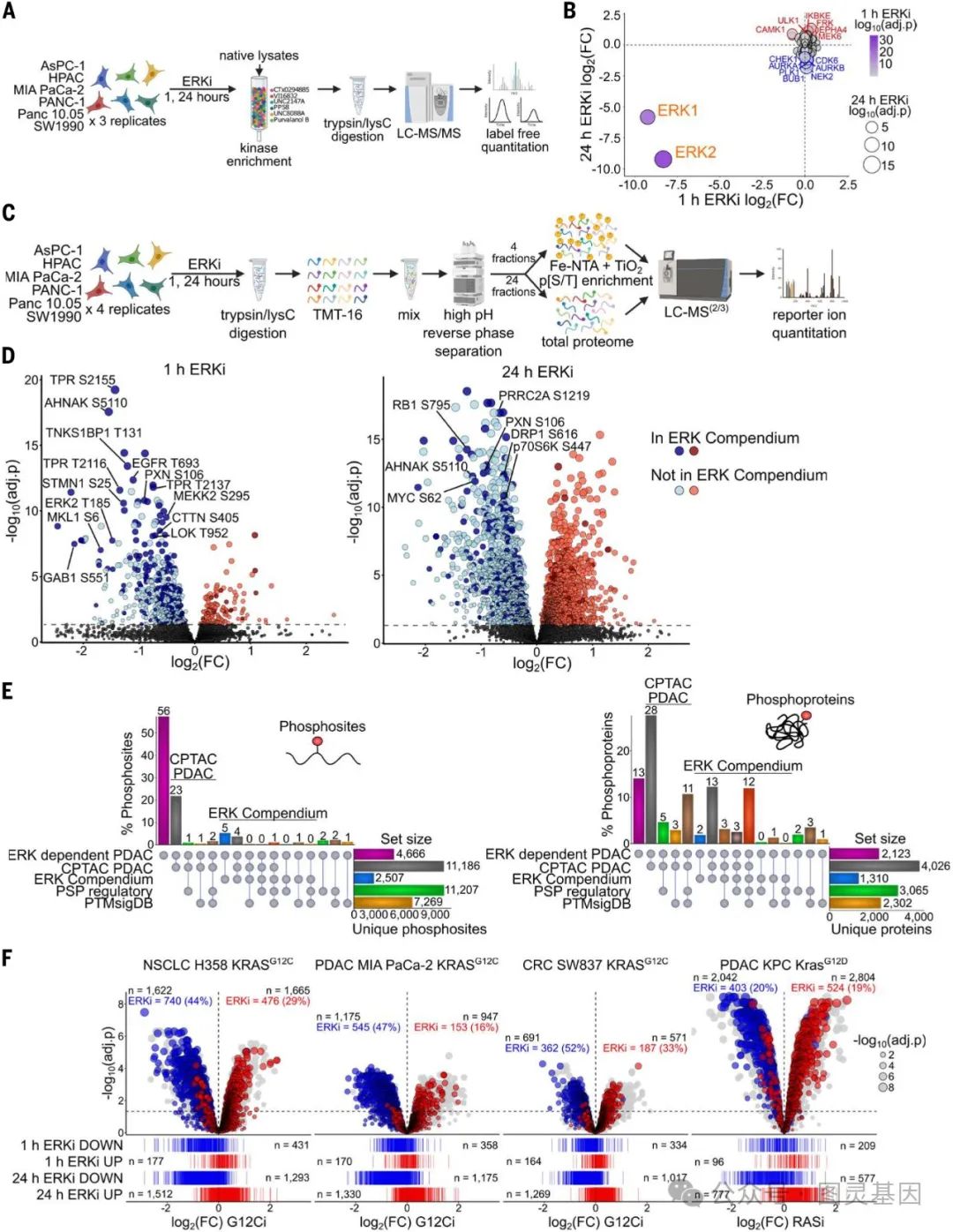
2 、 KRAS 突变体 PDAC 中 ERK 依赖性磷酸化蛋白组
图 2. KRAS 突变体 PDAC 中 ERK 调控的磷蛋白组学测定
作者利用选择性 ERK 抑制剂 SCH772984 ,对 6 株 KRAS 突变的胰腺癌细胞系进行短期 (1 小时 ) 和长期 (24 小时 ) 处理,并采用质谱技术分析了 ERK 依赖的磷酸化蛋白组,反映了 KRAS 驱动的胰腺癌特点。进一步分析发现,这个 ERK 依赖磷酸化蛋白组也是 KRAS 依赖磷酸化蛋白组的重要组成部分,在不同类型 KRAS 突变肿瘤中均有体现。综上所述,这个基于 KRAS 突变胰腺癌的 ERK 依赖磷酸化蛋白组具有较强的生物学相关性。
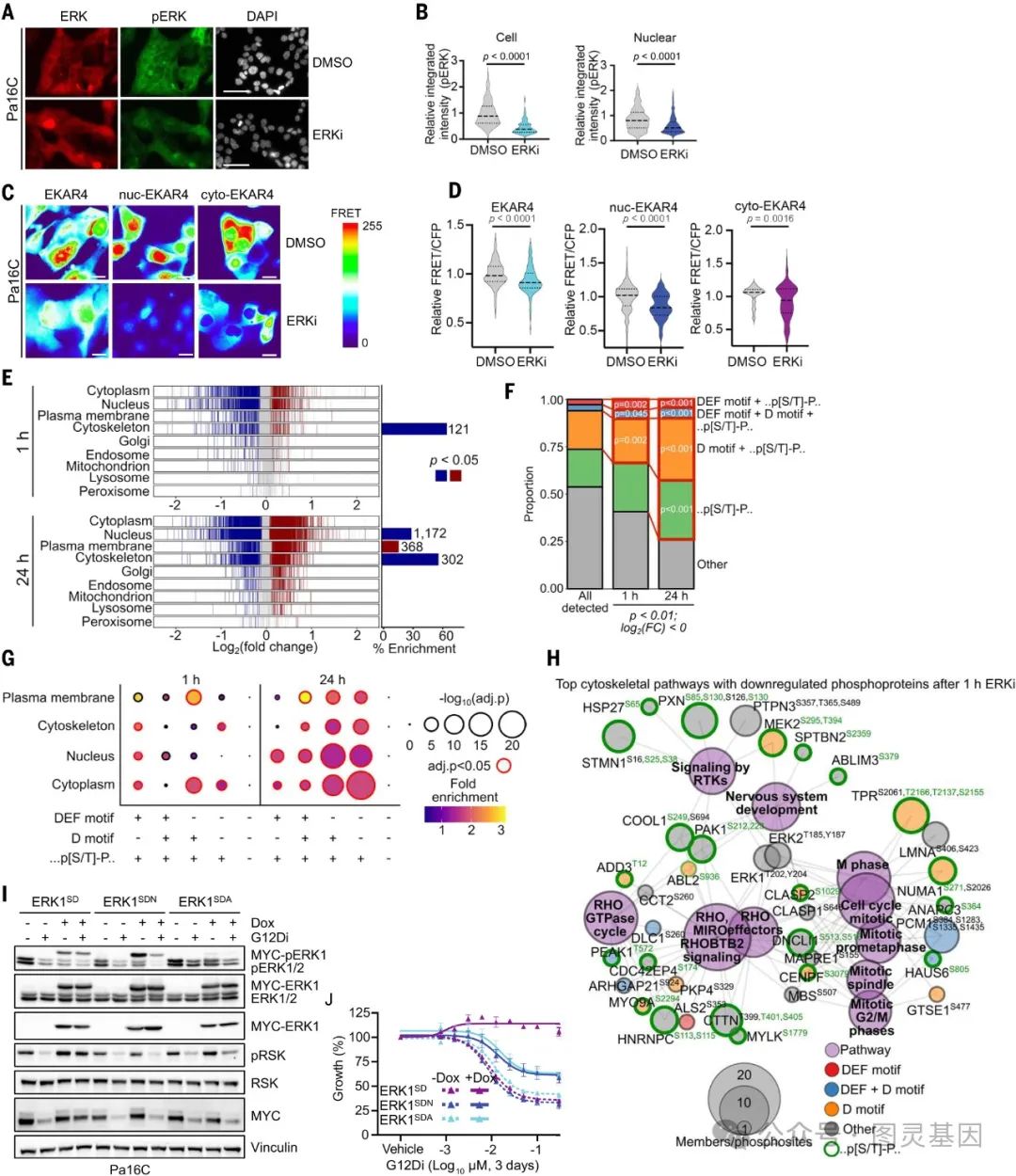
3 、 ERK 调控一个富含 ERK 相互作用基序的全局磷酸化蛋白组
图 3. ERK磷酸化蛋白质组调节由富含 ERK结合基序的蛋白质组成的多种功能途径
细胞外刺激促进 ERK 的瞬时磷酸化和激活,导致 ERK 从细胞质转移到细胞核。为了评估突变 KRAS 持续激活条件下活化 ERK 的亚细胞分布,通过免疫荧光和基于活性探针的方法,研究团队发现在 KRAS 突变胰腺癌细胞中, ERK 持续活化并定位于细胞质和细胞核中。抑制 ERK 后,细胞质和细胞核中的 ERK 活性均显著降低。 KRAS 突变胰腺癌中持续活化的 ERK 通过与含有特定结合位点的底物作用,调控细胞骨架、细胞周期、转录等多种细胞过程,从而维持 KRAS 依赖的肿瘤生长。
4 、 ERK 调节 PDAC 生长的关键蛋白
图 4. ERK依赖性 PDAC磷酸化蛋白质组的遗传依赖性
作者将 ERK 调控的磷酸化蛋白组与 DepMap 数据库中 KRAS 突变胰腺癌细胞株的基因依赖性进行分析,发现 ERK 调控的约一半磷酸化蛋白具有强依赖性。这些具有高依赖性的 ERK 调控磷酸化蛋白主要定位于细胞核,也包括一定比例的细胞质蛋白。进一步分析发现, ERK 调控的 RhoGTPase 通路、细胞周期调控通路以及 RNA 代谢通路上的蛋白,在 KRAS 突变肿瘤中表现出更强的基因依赖性。综上所述, ERK 通过调控涉及细胞核、细胞质和代谢等多个关键过程的蛋白,发挥支持 KRAS 突变胰腺癌生长的重要作用。
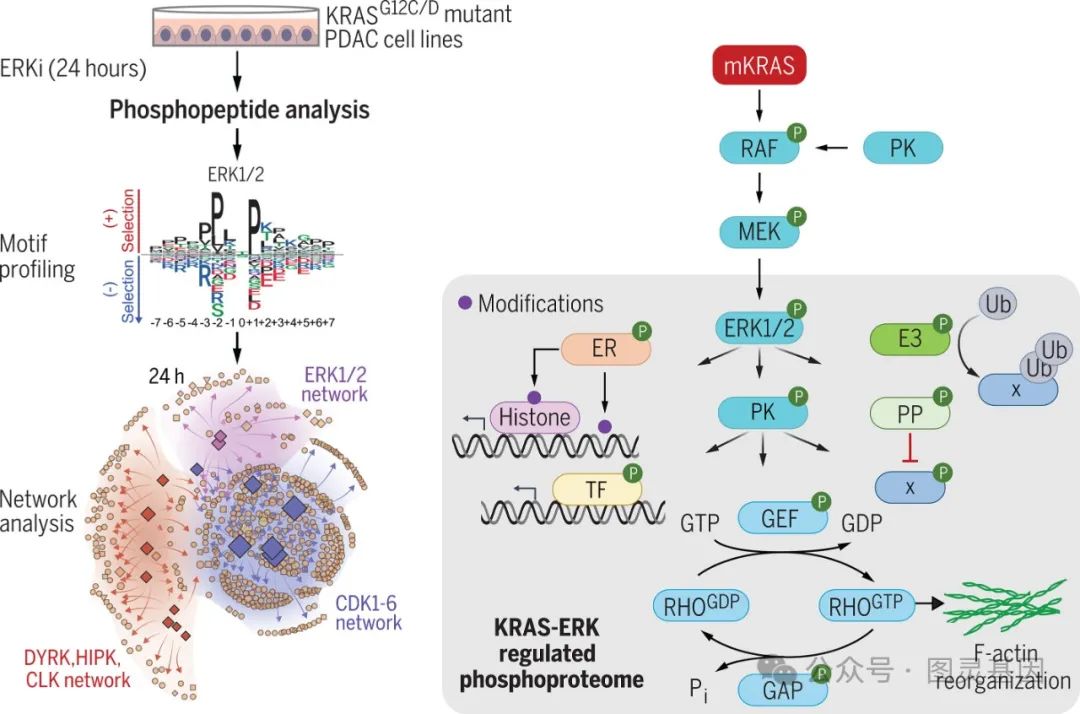
图5. 研究模式图
在这项工作中,作者已经建立了迄今为止最全面的病理 ERK 信号传导后果的分子图谱,它控制着许多破坏正常细胞周期调节的细胞过程。最近批准的直接 KRAS 抑制剂标志着 KRAS 突变型癌症治疗的一个重要里程碑。然而,获得性耐药的快速发生主要是由 ERK 再激活驱动的,这也强调了充分阐明 ERK 如何支持 KRAS 的致癌功能对于 KRAS 抑制剂的临床进展至关重要。鉴于 ERK 的再激活是 KRAS 抑制剂治疗获得耐药的主要基础,这一突变 KRAS 驱动的病理 ERK 信号的综合分子图谱将对阐明患者对 KRAS 抑制剂的反应和耐药机制具有重要意义。
作者介绍
Clint A. Stalnecker ,北卡罗来纳大学助理教授。 工作重点是癌基因如何重编程细胞代谢使其不受控制的生长和抵抗靶向治疗。
参考文献
Jennifer E. Klomp et al. , Determining the ERK-regulated phosphoproteome driving KRAS-mutantcancer.Science384 , eadk0850(2024).
链接:http://www.lewenyixue.com/2024/06/28/Science%20%EF%BD%9C%20%E8%9B%8B%E7%99%BD%E6%BF%80%E9%85%B6ERK%E8%B0%83%E6%8E%A7%E7%9A%84/








赶快来坐沙发