Cancer Cell | CD8+-CD4+-DCs免疫三联体能显著提高免疫疗法介导的实体瘤清除效果
肿瘤浸润性功能失调CD8+ T细胞通常高表达抑制性受体 (PD-1、LAG3、CTLA-4和TIM3) 水平下降,且无法产生效应细胞因子 (如IFNγ和TNFα) 和细胞毒性分子 (颗粒酶和穿孔素) 。通过给患者大量输注肿瘤反应性效应CD8+T细胞的过继性T细胞疗法 (ACT) 已成为强大的治疗策略之一,然而,大多数患者未能实现长期缓解,主要原因包括这群细胞在体内持久性、定位和浸润性差以及效应功能快速丧失 【1-3】 。很多研究表明CD4+T细胞可能通过促使树突状细胞 (DCs) 成熟、可分泌IFNγ消除MHC II类阴性癌细胞或通过分泌IFNγ和TNFα诱导癌细胞衰老而非消除来发挥抗肿瘤效应 【4-6】 ,但如何利用肿瘤反应性CD4+ T细胞来预防或逆转CD8+ T细胞功能障碍的肿瘤根除尚不清楚。
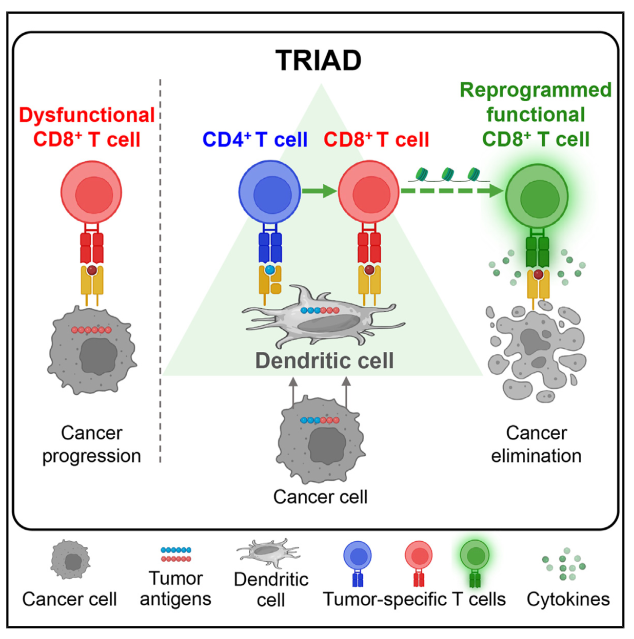
2024年6月20日,来自纪念斯隆·凯特琳癌症中心的 Andrea Schietinger 团队在 Cancer Cell 杂志上发表了文章 Intratumoral immune triads are required for immunotherapy-mediated elimination of solid tumors ,他们 证明肿瘤反应性CD4+和CD8+ T细胞与抗原呈递细胞 (APC) 一起形成“三联体”时,CD4+T细胞在实体瘤内介导肿瘤特异性CD8+ T细胞重编程,逆转其功能障碍。此外,在接受免疫检查点阻断 (ICB) 治疗的胸膜间皮瘤患者中,三联体与临床反应相关 。这些发现提示CD4+ T细胞-CD8+ T细胞-APC三联体的形成是提升ACT和ICB对实体瘤功效的关键因素。
该团队首先利用临床癌症患者采用的ACT方案来治疗接种改造的B16黑色素瘤细胞系 (表达能被CD8+T细胞识别的卵清蛋白OVA 257-264 以及表达能被CD4+T细胞识别的LCMV糖蛋白表位GP 61-80 ) 的小鼠,功能强大的效应CD8+T细胞并未减缓肿瘤进展,若同时输注体外激活的效应CD4+T细胞可实现小鼠100%的长期无瘤生存,同时,肿瘤浸润CD8+T细胞数量并未增多,但分泌的IFNγ和TNFα的能力增强,而肿瘤引流淋巴结中的肿瘤特异性CD8+T细胞却无差异,在第二个接种纤维肉瘤细胞系MCA205采取同样操作也得到类似结果,提示CD4+T细胞可逆转肿瘤特异性CD8+T细胞功能障碍来消除肿瘤。为了解其中机制,该团队从肿瘤中分离出两种T细胞进行RNA-seq和ATAC-seq分析,证明CD4+T细胞可通过转录和表观遗传重变成CD8+T细胞阻止其终末分化,来清除肿瘤。
肿瘤基质中包含CD11c+ DCs和巨噬细胞,该团队发现耗尽CD11c+ DCs后上述方案则无法消除肿瘤,但抗原特异性CD8+和CD4+ T细胞并无明显差异。于是该团队着眼于肿瘤内的空间特征,共聚焦显微镜结果显示三种细胞在物理空间上形成“三联体”结构。那么这种三联体结构是否与人类肿瘤患者的临床反应相关呢?为此,他们评估了接受ICB治疗的恶性胸膜间皮瘤患者中CD8+ T细胞、CD4+ T细胞和APC的空间关系,发现三联体的有无能区分ICB有反应者和无反应者,提示三联体可能是恶性胸膜间皮瘤患者抗肿瘤免疫反应性的关键决定因素。
综上所述,这项工作证明 CD4+ T细胞介导的CD8+ T细胞重编程和癌细胞消除严格依赖于免疫三联体的形成,也解释了为什么主要利用肿瘤反应性CD8+ T细胞的ACT临床试验仅显示出对实体瘤治疗的有限反应。
https://doi.org/10.1016/j.ccell.2024.05.025
制版人:十一
1. Yee, C., Thompson, J.A., Byrd, D., Riddell, S.R., Roche, P., Celis, E., andGreenberg, P.D. (2002). Adoptive T cell therapy using antigen-specific CD8+ T cell clones for the treatment of patients with metastatic melanoma: in vivo persistence, migration, and antitumor effect of transferred T cells. Proc. Natl. Acad. Sci. USA 99, 16168–16173. https://doi.org/10.1073/pnas.242600099.
2. Dudley, M.E., Wunderlich, J.R., Robbins, P.F., Yang, J.C., Hwu, P.,Schwartzentruber, D.J., Topalian, S.L., Sherry, R., Restifo, N.P., Hubicki,A.M., et al. (2002). Cancer regression and autoimmunity in patients after clonal repopulation with antitumor lymphocytes. Science 298, 850–854.https://doi.org/10.1126/science.1076514.
3. Stromnes, I.M., Schmitt, T.M., Hulbert, A., Brockenbrough, J.S., Nguyen,H., Cuevas, C., Dotson, A.M., Tan, X., Hotes, J.L., Greenberg, P.D., et al.(2015). T Cells Engineered against a Native Antigen Can Surmount Immunologic and Physical Barriers to Treat Pancreatic Ductal Adenocarcinoma. Cancer Cell 28, 638–652. https://doi.org/10.1016/j.ccell.2015.09.022.
4. Bos, R., and Sherman, L.A. (2010). CD4+ T-cell help in the tumor milieu is required for recruitment and cytolytic function of CD8+ T lymphocytes. Cancer Res. 70, 8368–8377. https://doi.org/10.1158/0008-5472.CAN-10-1322.
5. Greenberg, P.D., Kern, D.E., and Cheever, M.A. (1985). Therapy of disseminated murine leukemia with cyclophosphamide and immune Lyt-1+,2- T cells. Tumor eradication does not require participation of cytotoxic T cells. J. Exp. Med. 161, 1122–1134.
6. Braumuller, H., Wieder, T., Brenner, E., Assmann, S., Hahn, M., Alkhaled, M., Schilbach, K., Essmann, F., Kneilling, M., Griessinger, C., et al. (2013). T-helper-1-cell cytokines drive cancer into senescence. Nature 494, 361–365. https://doi.org/10.1038/nature11824.
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/06/24/Cancer%20Cell%20%7C%20CD8%2B-C/
THE END






赶快来坐沙发