浅谈MRI引导下冷冻消融治疗小肾脏肿瘤
本研究旨在评估MRI引导的冷冻消融治疗小肾脏肿瘤的长期疗效和生存情况。研究回顾了既往的肾脏消融数据库,并得出结论:MRI引导的冷冻消融是治疗小肾脏肿瘤的有效治疗方法,具有长期的疾病控制效果。
介绍
影像引导下经皮穿刺热消融(TA)已成为治疗cT1a肾细胞癌(RCC)的一种有效策略。 该技术特别适用于不宜进行外科手术的患者:老年患者,尤其是伴合并症和多发肿瘤的患者。与部分肾切除术(PN)相比,TA具有良好的围手术期预后和较低的并发症发生率,这使得TA成为该类患者优选的治疗模式。此外, 中长期数据显示,TA的肿瘤预后与部分肾切除术相当。因此,AUA和NCCN指南已将热消融(TA)作为cT1a RCC的治疗选择。
虽然大多数影像引导的经皮穿刺冷冻消融是在计算机断层扫描(CT)成像引导下进行的, 但磁共振成像(MRI)具备自己独特的优势,使其成为消融成像引导的理想选择之一。 首先,可用的MRI脉冲序列阵列有助于表征目标病变的组织。MRI提供了优越的对比度分辨率,能够识别和精确定位肿瘤,特别是脏器实质内和腔内病变,但这些病变可能难以用CT或超声可视化。
同时,在无需进行对比的情况下, MRI提供了肿瘤边界及其与周围结构(包括血管)关系的更精细分辨率, 从而可能会带来降低并发症风险的治疗获益。其次, MRI多平面重建能力优势突出, 可以对困难位置的病变(例如小的肾上极病变)进行精确的穿刺引导,其中斜入路可以帮助避免在消融过程中刺穿胸膜间隙。
再者,MRI允许在任何平面上成像,即使采用双斜入路,也能实现整个针路的可视化,这也是当前迭代CT成像软件刚刚开始纳入的一个功能。此外,实时MRI可以监测消融过程,更好地监测冰球范围而无需将患者暴露于电离辐射之下。与CT成像相比,MRI可以很好地显示冰球对腹膜后脂肪的影响。最后,MRI是一种可靠的工具,可提供消融区扩展的即时评估,并确保在足够的安全范围内完成肿瘤消融。
MRI引导肾消融术的报道数据有限。 先前的一项研究阐述了MRI引导冷冻消融技术。在此,我们正在评估MRI引导下经皮冷冻消融治疗活检证实的cT1a RCC患者的长期肿瘤疗效和生存率,期望获得可靠的临床实践成果。
数据来源与方法
我们对自己所属机构的肾脏消融数据库进行了回顾性分析。在本研究中,我们纳入了在 2007年1月至2021年6月期间通过活检证实的CT1a RCC(≤4 cm)接受冷冻消融术的患者。我们排除了复发性RCC、遗传综合征、双侧RCC、组织学上未被证实为RCC的病变(即良性病变或非诊断性活检病变)以及在CT成像引导下下接受射频消融或冷冻消融的患者。
2.1. 消融过程
MRI引导下肾脏肿瘤消融的详细手术过程描述已在之前发表。在我们中心,所有MRI引导的冷冻消融都是在全身麻醉下进行的,通过MRI兼容的冷冻消融系统, 主要用于CT上不能理想判断的肾脏病变,借助18通道1.5 T MRI扫描仪(MAGNETOM Espree, Siemens Medical System, Erlangen, Germany)进行成像,平衡稳态自由进动(bSSFP)技术用于规划和定位。
在探针穿刺期间,使用BEAT IRTTT序列进行实时成像以进行连续监测。图1显示了MRI引导肾冷冻消融术的病例,该患者参与了本研究。在消融结束时,进行多期增强MRI检查以确认肿瘤完全消融并确定是否存在相关并发症。定期随访24个月,进行非增强和对比增强的横断面影像检查,随访结束后每年进行一次相关检查即可。
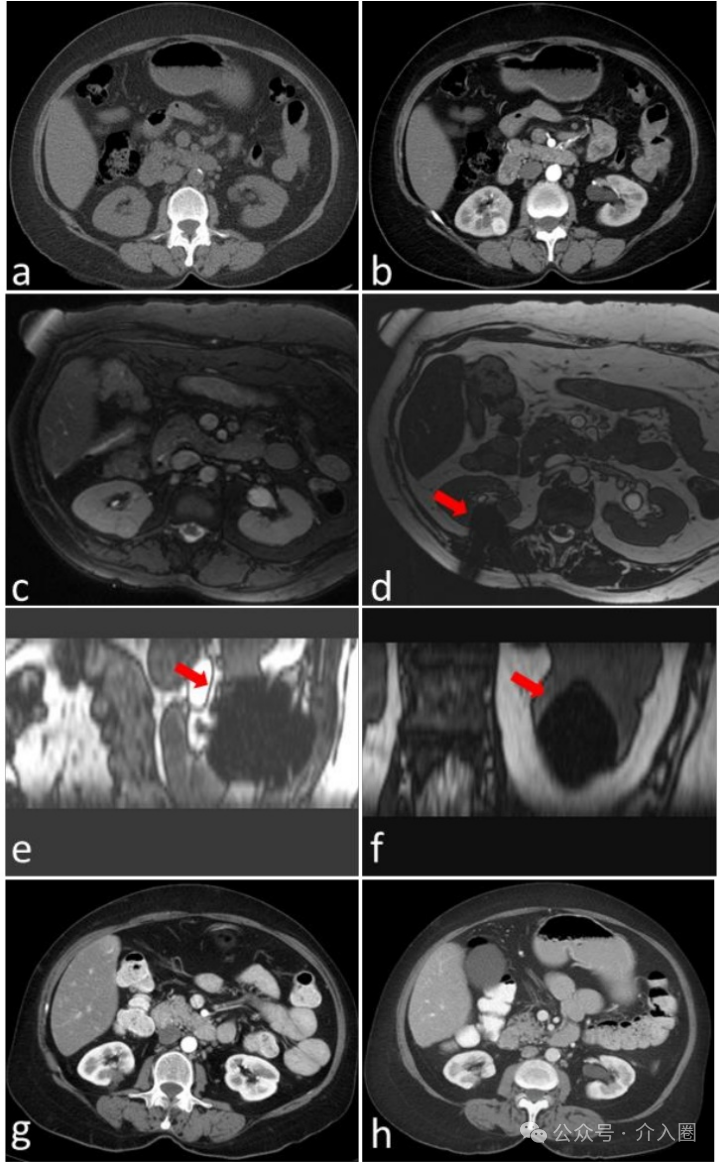
▲ 图1
活检证实的右肾肾细胞癌的非增强CT (a)和增强CT (b)。非增强CT显示肿瘤等密度;因此,我们决定进行MRI引导的肾脏消融术。(c-f) MRI引导肾冷冻消融手术。(c)(TRUFI)显示1.5 cm肾肿块。(d)轴位、(e)矢状和(f)冠状TRUFI显示冷冻消融过程中的低信号冰球(箭头)。(g,h)术后6个月(g)和10年(h)随访对比增强CT图像。
1.2. 数据收集
我们回顾分析了每位患者的相关病历,通过人口统计学、肿瘤大小和侧面、辅助技术、并发症(根据Clavien-Dindo分类系统分级)和病理(RCC组织学、亚型及其Fuhrman分级)等进行了记录。并回顾了分析了所有可用的放射学影像资料,以评估肿瘤在消融区内或消融区外的复发和转移性疾病。我们也记录了患者在数据收集时是否存活、死亡日期和原因以及随访时间等相关事宜。
2.3. 结论定义
在本研究中, 标准的消融疗效代表一次完全消融肿瘤,总体消融疗效代表需要一次以上消融才能实现肿瘤完全消融的患者。当在第一次随访的横断面成像中发现消融区域增强时,报告为肿瘤残留。局部复发是指6个月或之后在消融区出现新的对比增强,而在先前的随访影像中没有发现。总生存期(OS)代表最后随访时存活的患者比例。局部无复发生存(RFS)代表消融区无任何残留/复发的患者比例。无转移生存期(MFS)代表无任何远处转移性疾病患者的比例。无病生存期(disease -free survival, DFS)代表消融区内外无任何恶性肿瘤复发或远处疾病复发的患者比例。癌症特异性生存(CSS)代表未死于RCC的患者比例。
2.4. 数据分析与统计
我们使用Kaplan和Meier方法估计OS、RFS、MFS、DFS和CSS的分布,从手术日期到消融区内或消融区外肾脏复发、远处转移或死亡日期计算生存率,通过分析诸多可变因素从而最终得出相关数据报告。
结果
29例患者(男18例,女11例)符合纳入标准,中位年龄72岁(范围50-81岁)。
3.1. 程序结果
29例患者活检证实的RCC病变总共进行了29次手术。中位肿瘤大小为2.2 cm(范围1-4 cm,平均2.2 cm)。RCC病变累及右肾和左肾分别为21例和8例。10例患者使用了水隔离技术,以避免肠/结肠(n = 5)、脾脏(n = 1)或腰肌/后腹壁(n = 4)的损伤。水隔离辅助技术在所有病例中都取得了成功。标准的消融疗效为100%,没有患者需要第二次治疗来实现完全的肿瘤消融。患者和病变特征列于表1。
2例患者(6.9%)出现并发症。 1例患者出现肾周血肿(I级Clavien-Dindo并发症),通过观察保守治疗,不需要进一步干预。另一名患者出现气胸(III级Clavien-Dindo并发症),需要放置临时胸管。

▲表1 患者及肿瘤特征
3.2. 组织学结果
本研究仅包括经活检证实的RCC病变(n = 29)。最常见的组织学亚型是透明细胞RCC (n = 19, 65.5%),其次是乳头状RCC (n = 8, 27.5%)。1例(3.5%)为透明细胞乳头状RCC, 1例(3.5%)为嫌色RCC。25个病变报告了Fuhrman分级:6个病变为1级,19个病变为2级。组织学特征总结于表2。

RCC,肾细胞癌;NR*,未见报道。
▲表2 活检组织学结果
3.3. 肿瘤学和生存状况
所有患者均接受临床和影像学随访,中位随访时间为4.5年(0.9-13.3年,平均5年)。随访期间, 所有患者均无病灶残留或消融区局部复发。
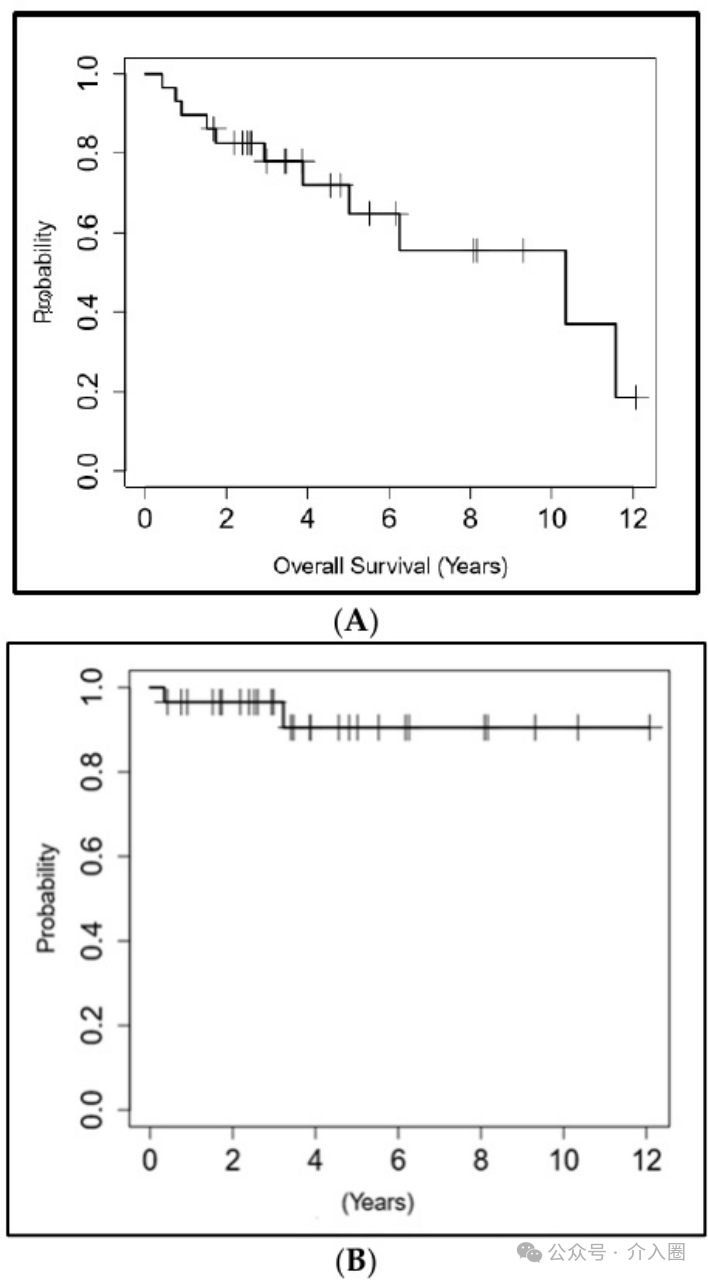
2例患者(6.9%)出现新的病变 :1例患者在与消融区分离的同侧肾脏出现病变,另1例患者在对侧肾脏出现新的病变。这两个新病变分别通过消融术和主动监测进行处理。 11例患者在数据回顾时死亡,但没有一例死于RCC。3年、5年和10年OS分别为78%、72%和55.6%。3年、5年和10年DFS分别为96.6%、90.5%和90.5%。3、5、10年RFS、MFS和CSS均为100%。图2分别显示了OS和DFS的Kaplan和Meier图。
▲图2 Kaplan-Meier生存曲线 (A)总生存期 (B)无病生存期
讨论
关于核磁共振引导的肾肿瘤冷冻消融以及相关的肿瘤和生存结果的数据报道是有限的。在这里,我们分享我们在三级癌症中心使用核磁共振引导肾脏冷冻消融的经验。在目前的研究中,我们概述了核磁共振引导冷冻消融组织学证实的cT1a RCC的中期到长期肿瘤学和生存结果。 5年OS、RFS、DFS、MFS和CSS分别为72%、100%、90.5%、100%和100%。10年OS、RFS、DFS、MFS和CSS分别为55.6%、100%、90.5%、100%和100%。
该研究中仅有2例并发症(6.9%)。这与先前核磁共振引导肾脏冷冻消融研究中报道的并发症发生率一致,也与其他评估RCC冷冻消融安全性和有效性的研究中报道的冷冻消融后并发症发生率一致。
核磁共振固有的高对比度分辨率能够精确描绘肿瘤边界及其与周围结构的关系。这对于在非增强CT扫描上可能难以可视化的实质内(内生)肿瘤尤其有益。 此外,在没有造影剂的情况下,冰球和水解剖的最佳可视化增强了手术的安全性,降低了对附近器官损伤的风险。在我们的回顾性分析中,只有1名患者(3.4%)发生气胸。输尿管盂连接处、小肠、脾脏或结肠均无损伤。
核磁共振成像的另一个主要优点是没有电离辐射。 这一优势解决了CT引导下肾脏冷冻消融的潜在问题。 这一优势尤其适用于年轻患者可能重复消融的新病变,如有多发性病变的希佩尔·林道综合征(Von Hippel–Lindau disease,VHL综合征)患者,以及患有其他非肾脏原发性恶性肿瘤的年轻患者,这些患者由于反复和长期的横断面成像随访,累积辐射剂量的可能性增加。
核磁共振引导冷冻消融有一些缺点。首先,在放置多个探头时,核磁设备狭窄的孔径有时会带来挑战;其次,表面的磁线圈限制了探头放置的可用表面积;第三,当多个探头到位时,针头伪影会干扰肿瘤的可视化;第四,与CT引导手术相比,核磁共振引导手术通常需要更长的时间。
关于生存结果,我们报道的5年OS为72%,低于核磁共振引导冷冻消融报道的OS数据。这种较低的OS率主要是由于我们三级癌症中心的患者群体的性质。在目前的研究中,29例患者中有18例(62%)同时患有非肾恶性肿瘤。据过去报道,与仅RCC患者相比,另一种非肾恶性肿瘤的存在对OS有影响。
在这里,我们提出了有希望实现的5年生存率,特别是我们5年估计的LRFS(100%)。我们的存活率与其他研究者报告的结果非常接近。
在最近的一项单臂回顾性研究中,Cazzato等人介绍了他们在MRI引导下冷冻消融治疗肾脏肿瘤10年的经验。作者报告了143例患者的肿瘤学和生存结果。 他们的5年次要RFS为91.1%,MFS为91.5%,DFS为75.1%,CSS为98.2%。
同样,Bhagavatula等人评估了影像引导下经皮冷冻消融cT1 RCC的中期至长期结果。作者报道,在接受MRI引导冷冻消融的患者亚组中,5 年RFS为94%,DFS为92%,CSS为100% (n = 152)。这也与文献中冷冻消融的生存数据一致,这些数据大多是针对CT引导下的冷冻消融患者。
在Georgiades等人的一项前瞻性研究中,研究了经皮冷冻消融治疗活检证实的RCC的安全性、有效性和结果。 本研究纳入了134例T1a肾肿瘤患者,5年有效率为97%,MFS和CSS发生率均为100%。
在最近的一项回顾性单机构研究中,Breen等人报道了他们对268例活检证实的RCC进行冷冻消融的经验,在一次消融治疗后,所有治疗病灶的治疗效率为95.6%,在该组患者中,后续消融治疗的治疗效率增加到98.1%。 在5年的时间里,6例患者出现局部复发,相应的无复发生存率(RFS)和无转移生存率(MFS)分别为93.9%和94.4%。
Duus等对122例活检证实为T1 RCC的患者进行了冷冻消融治疗,共计128例,其中117例为T1a RCC。T1a RCC亚组的3年无病生存率为95%。
我们承认本研究的局限性。首先,它本质上是回顾性的,在患者选择上存在固有的偏见;其次,纳入研究的患者数量较少;第三,这是一项单臂研究,没有对照组即接受CT引导冷冻消融的患者;第四,考虑到MRI介入套件的有限可用性,本研究结果的广泛应用受到限制。然而,我们的研究为MRI引导冷冻消融的安全性和肿瘤学有效性提供了越来越多的证据。
结论
MRI引导冷冻消融是一种安全、高效的治疗相对较小RCC的方法,中期至长期随访数据显示了长期有效的肿瘤治疗和生存结果,同时并发症发生率低。
链接:http://www.lewenyixue.com/2024/06/24/%E6%B5%85%E8%B0%88MRI%E5%BC%95%E5%AF%BC%E4%B8%8B%E5%86%B7%E5%86%BB%E6%B6%88%E8%9E%8D%E6%B2%BB%E7%96%97%E5%B0%8F%E8%82%BE%E8%84%8F%E8%82%BF%E7%98%A4/










赶快来坐沙发