Science | 发现全新的化疗诱导癌细胞自杀途径
化疗可以杀死癌细胞,但荷兰癌症研究所的一个团队领导的研究人员现在发现,这些细胞的死亡方式似乎与之前所理解的不同。他们的体外研究揭示了一种全新的癌细胞死亡方式,这种死亡方式与 Schlafen 11 ( SLFN11 )基因和核糖体停滞有关。“这是一个非常出乎意料的发现。”该研究的联合负责人 Thijn Brummelkamp 博士说,“癌症患者接受化疗已有近一个世纪的历史,但这种导致细胞死亡的途径以前从未被观察到。这种情况何时何地发生在患者身上需要进一步调查。这一发现最终可能会对癌症患者的治疗产生影响。”
Brummelkamp 及其同事在《 Science 》杂志上发表了他们的研究结果。在他们题为“ DNA damageinduces p53-independent apoptosis through ribosome stalling ”的论文中,该团队指出,“这些结果为 SLFN11 在化疗无反应的肿瘤中频繁失活提供了解释,并强调核糖体停滞是一种影响细胞对 DNA 损伤命运的信号事件。
许多癌症治疗会损害细胞 DNA 。在受到太多无法修复的损伤之后,细胞会自行死亡。众所周知, p53 蛋白负责这一过程。作者写道,这种蛋白质“被称为基因组的守护者”,可以确保受损 DNA 的修复,但当损伤变得过于严重时,会引发细胞自杀。这可以防止不受控制的细胞分裂和癌症的形成。该团队进一步表示:“ p53 蛋白可以被 DNA 损伤激活,并作为转录因子发挥作用,诱导细胞周期停滞,从而进行损伤修复或诱导细胞凋亡。”
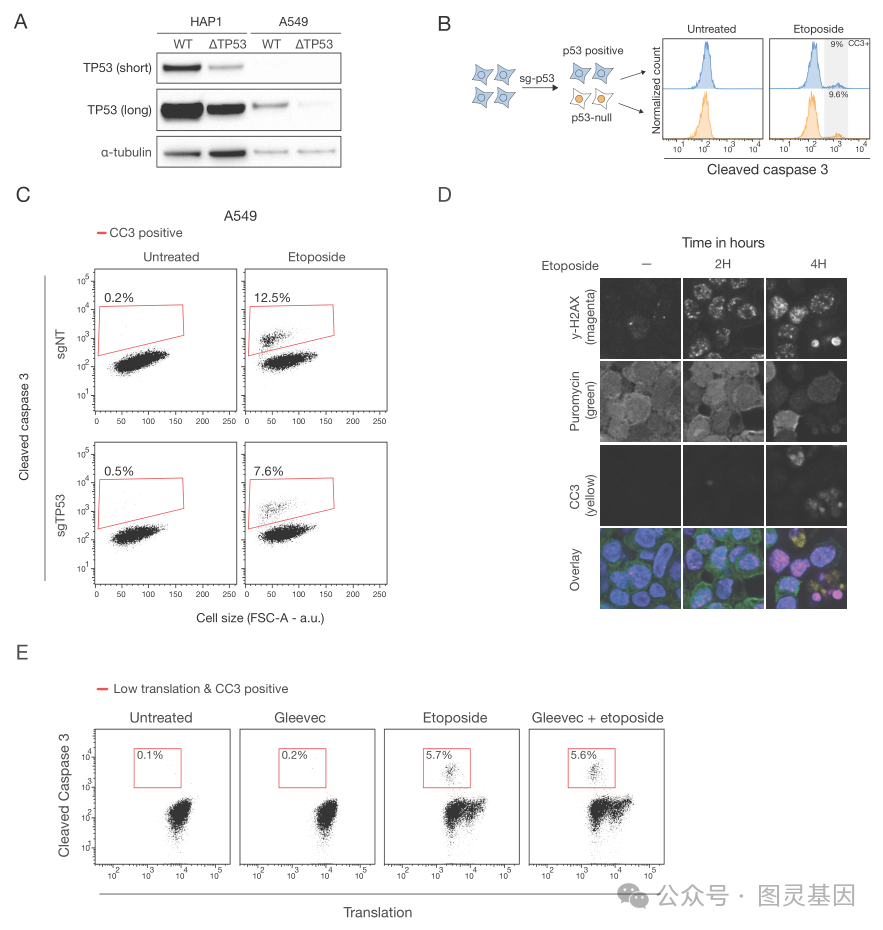
缺乏 p53 的细胞在 DNA 受损时仍会发生细胞凋亡,但相关途径尚不清楚,作者继续说道。因此,尽管通过破坏肿瘤细胞的 DNA 来消除肿瘤细胞的放疗或化疗等癌症治疗方法可以激活 p53 蛋白,但 p53 通路有缺陷的细胞仍有可能因 DNA 损伤而发生凋亡,“尽管对相关通路还没有明确的了解。”研究小组指出,“了解这些途径可能是相关的,因为 30% 至 50% 的癌症都含有突变的 TP53 ,而这些肿瘤仍然使用基因毒性疗法治疗,而不考虑这些突变。” Brummelkamp 继续说道:“在超过一半的肿瘤中, p53 不再起作用。关键的 p53 在那里不起作用。那么,为什么当你用化疗或放疗破坏癌细胞的 DNA 时,没有 p53 的癌细胞仍然会死亡呢 ? 令我惊讶的是,这是一个没有答案的问题。”
通过他们报告的研究,该团队与 NCI 同事 Reuven Agami 博士团队的研究人员一起,发现了 DNA 损伤后细胞死亡的一种以前未知的方式。该团队使用 Brummelkamp 开发的单倍体细胞技术进行了体外研究。这些细胞只包含每个基因的一个拷贝,而不像我们体内的普通细胞包含两个拷贝。在基因实验中,处理两个拷贝可能具有挑战性,因为变化(突变)经常只发生在其中一个拷贝上。这使得观察这些突变的影响变得困难。 Brummelkamp 解释说:“我们一直在寻找一种能让细胞在化疗中存活下来的基因变化。我们的团队在选择性禁用基因方面有很多经验,我们可以完美地应用于此。”
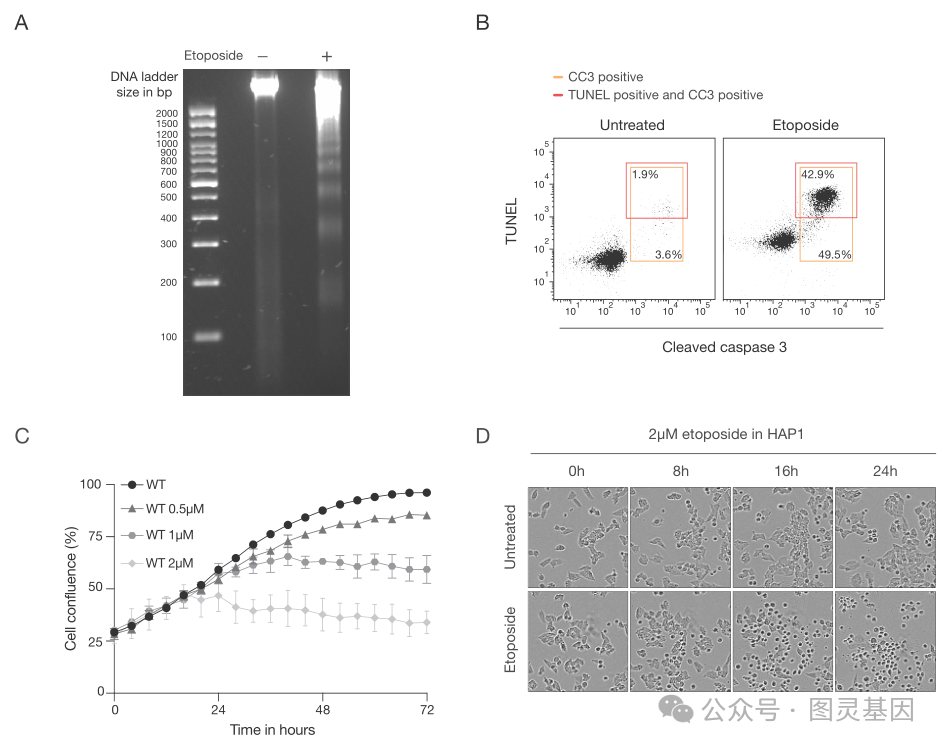
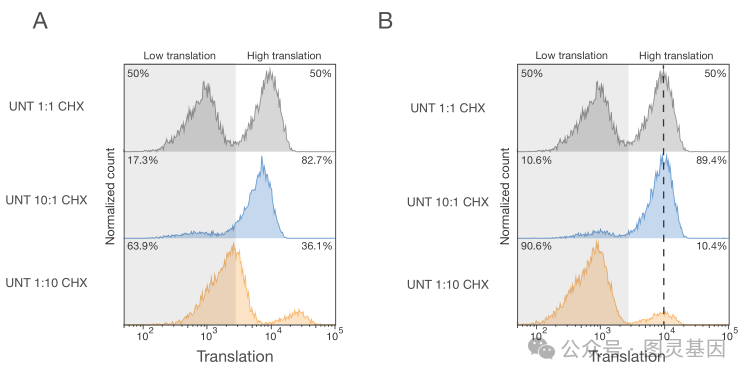
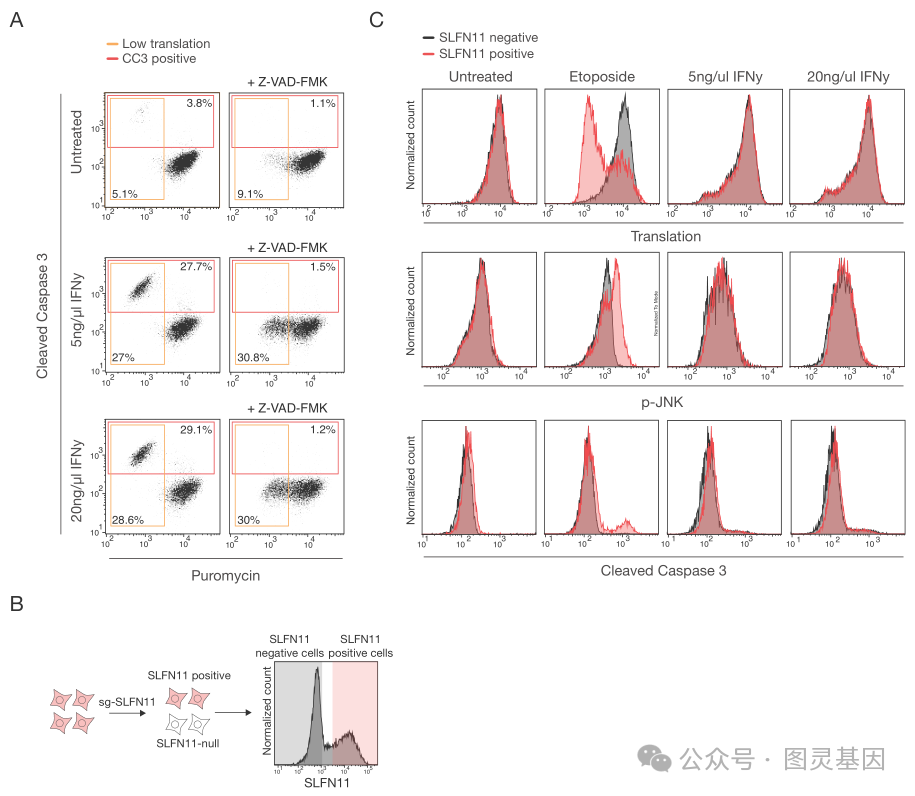
该团队首先证实,人类单倍体 HAP1 细胞在暴露于化疗药物依托泊苷、顺铂或羟基脲后发生凋亡,这些化疗药物通过不同的机制诱导 DNA 损伤。然后,通过关闭基因,研究小组发现了一种与 Schlafen 11 基因有关的新的细胞死亡途径。首席研究员 Nicolaas Boon 博士进一步解释道,“在 DNA 受损的情况下, SLFN11 会关闭细胞的蛋白质工厂:核糖体。这会给这些细胞带来巨大的压力,导致它们死亡。我们发现的新途径完全绕过了 p53 。”
有趣的是,作者继续说道,“这里描述的 DNA 损伤反应不仅在不同来源的癌细胞系中观察到,而且也发生在从人类结直肠癌中获得的不同患者来源的类器官中。 SLFN11 被认为是化疗反应性最强的生物标志物,这表明核糖体停滞与癌症治疗的有效性有关。”
SLFN11 基因在癌症研究中并不陌生。 Brummelkamp 说,在对化疗无效的肿瘤患者中,它通常是不活跃的。“我们现在可以解释这种联系。当细胞缺乏 SLFN11 时,它们不会因 DNA 损伤而以这种方式死亡。细胞会存活下来,而癌症会持续下去。”
这一发现揭示了许多新的研究问题,这些情况通常出现在基础研究中, Brummelkamp 补充说:“我们已经在实验室培养的癌细胞中证明了我们的发现,但许多重要的问题仍然存在:这种途径在患者体内何时何地发生? 它如何影响免疫治疗或化疗? 它会影响癌症治疗的副作用吗? 如果这种形式的细胞死亡也被证明在患者中发挥重要作用,这一发现将对癌症治疗产生影响。这些都是需要进一步研究的重要问题。”
链接:http://www.lewenyixue.com/2024/05/31/Science%20%7C%20%E5%8F%91%E7%8E%B0%E5%85%A8%E6%96%B0%E7%9A%84%E5%8C%96%E7%96%97%E8%AF%B1%E5%AF%BC%E7%99%8C/







赶快来坐沙发