Nature | 3D基因组图谱映射技术研究胰腺癌前病变
撰文:克里斯
IF :64
推荐度: ⭐⭐⭐⭐⭐
亮点:
通过3D基因组映射技术,揭示了人类胰腺癌前病变(PanINs)的多灶性和遗传异质性。研究团队利用机器学习工具CODA对大量胰腺组织进行3D重建,发现正常成人胰腺可能含有数百个PanINs,几乎都带有KRAS基因突变。研究还发现,多数PanINs作为独立克隆存在,具有不同的突变特征,而少数PanINs表现出多克隆起源,即同一病变内存在多种KRAS突变。这些发现对于理解胰腺癌的早期发展至关重要,并为早期检测和治疗提供了新的方向。
2024年5月1日, 美国约翰斯·霍普金斯大学医学院 Laura D. Wood 教授研究团队 在 国际知名期刊 《 Nature 》 发表了题为: 3D genomic mappingreveals multifocality of human pancreatic precancers 的研究文章。

文章描述了研究团队如何利用机器学习管道CODA对大量人体胰腺组织样本进行3D重建,以单细胞分辨率量化PanINs的数量、尺寸和空间分布。通过对这些3D模型的分析,结合多区域显微切割和目标/全外显子测序,研究揭示了PanINs的遗传异质性和多灶性,发现大多数PanINs起源于具有独特体细胞突变特征的独立克隆。
1、背景
胰腺导管腺癌(PDAC)是一种特别侵袭性的恶性肿瘤,通常在晚期才被诊断,导致患者五年生存率仅为11%。PDAC的发展通常起源于非侵袭性的前驱病变,即胰腺导管内上皮瘤变(PanINs)。如果能够及早发现并治疗PanINs,是可以治愈的。
然而,PanINs的研究面临重大挑战,因为它们的体积很小,难以识别。目前对人类PanINs的研究通常依赖于对胰腺组织的切片进行二维(2D)分析,这种方法虽然可以识别PanINs的一部分,但是无法全面评估PanINs的总数、大小、形状或组织内的连接性,这些信息对于完全理解胰腺肿瘤发生的最早步骤至关重要。
为了克服2D分析的局限,研究人员提出了对更大组织块进行三维(3D)分析的必要性。文章中提到了CODA(一种用于3D图像分析的机器学习流程),它能够生成具有单细胞分辨率的大块组织的可量化模型。利用CODA,研究人员能够系统地评估大块人体胰腺组织,量化PanINs的数量和连接性,这为研究胰腺癌的早期发展提供了更全面的视角。
2、3D重建与NGS技术探究胰腺导管内上皮瘤遗传异质性

图1.CODA 3D建模和测序的组织处理工作流程以及样本队列
研究者创新性地采用3D重建技术(CODA)和下一代测序(NGS)来全面研究人类胰腺导管内上皮瘤(PanINs)的遗传结构和空间分布。在CODA和NGS的帮助下,研究者能够对胰腺组织进行精确的三维建模,并在单细胞分辨率下对PanINs进行系统的分析。这种方法允许他们识别和量化正常胰腺组织中的PanINs数量和分布,以及它们的大小和细胞组成。
为了进一步探究PanINs的遗传异质性,研究者对八个额外的胰腺组织样本进行了多区域DNA测序。这些样本通过3D建模来识别空间上不连续的PanINs,然后通过激光捕获显微切割(LCM)技术将这些区域单独分离出来进行NGS。使用定制的靶向NGS面板,研究者对154个已知的癌症驱动基因进行了测序,以识别PanINs中的单核苷酸变异(SNVs)和小的插入/缺失突变。
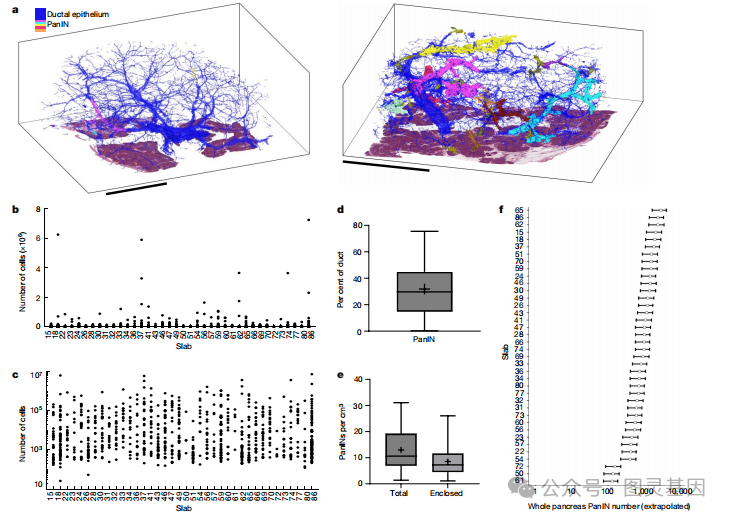
图2.3D建模技术量化PanINs微观解剖特征
此外,对于部分样本,还进行了全外显子测序(WES),以更全面地分析体细胞突变谱。
研究结果显示,大多数PanINs在遗传上是独立的克隆,它们具有独特的突变特征。尽管在空间上不连续的PanINs之间观察到了KRAS热点突变的共享,但这些突变很可能是通过随机事件独立获得的。此外,研究者还发现了一些PanINs具有多克隆起源的证据,这些PanINs在其不同的细胞亚群中携带多种KRAS热点突变。通过使用PICTograph软件,研究者重建了这些PanINs的亚克隆结构,进一步证实了它们的多克隆性质。同时,研究者还对突变特征进行了分析,以了解在胰腺肿瘤发生过程中发挥作用的不同突变过程。他们还通过超深度测序对KRAS基因的热点突变进行了分析,以验证NGS和WES的结果。
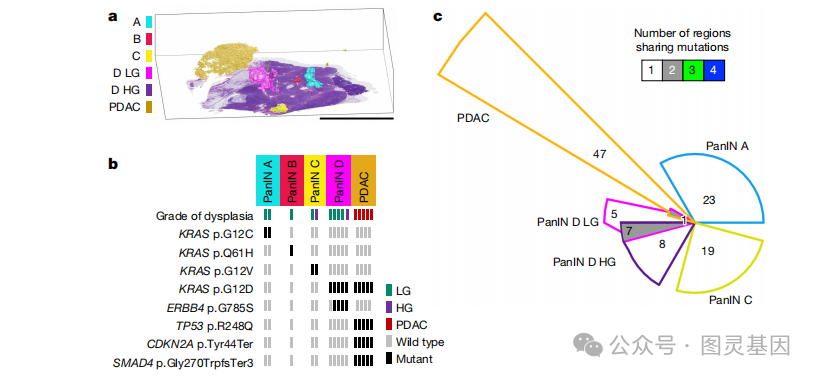
图3.三维建模结合下一代测序技术深入分析特定胰腺组织样本PanINs
这些发现不仅揭示了PanINs在胰腺癌发展中的复杂遗传景观,而且为早期检测和干预提供了潜在的靶点。通过这种3D基因组学方法,研究者能够更全面地理解PanINs的遗传结构和它们在胰腺癌发展中的潜在作用,为未来的研究和临床实践奠定了基础。
3、PanINs的克隆起源和遗传多样性
研究者对多个空间上不相连的PanINs进行靶向测序和全外显子组测序(WES),发现这些病变大多数情况下是独立出现的,具有独特的克隆起源。例如,在单个胰腺组织样本中的不同PanINs展现出不同的KRAS热点突变,表明它们是独立发展的克隆。此外,即使在组织学上连续的PanINs中,低级别(LG)和高级别(HG)区域共享相同的KRAS突变,而不同PanINs之间的突变则没有重叠,进一步证实了它们的独立性。研究还发现,一些PanINs在其内部展现出多种KRAS热点突变,通过突变胶囊分析和RNA原位杂交(ISH)技术确认了这些突变在空间分布上的差异,支持了某些PanINs可能具有多克隆起源的假设。这些发现对于理解PanINs的发展、它们如何转化为更具侵袭性的胰腺导管腺癌(PDAC),以及如何早期识别和干预这些病变具有重要意义。
教授介绍

Laura D. Wood 教授,曾在威廉与玛丽学院获得了生物学学士学位,之后她在约翰霍普金斯大学医学院获得了医学博士和哲学博士学位。在博士研究期间,她领导了人类癌症中首次进行的全外显子测序研究。随后,她在约翰霍普金斯医院完成了解剖病理学住院医师培训,并在胃肠和肝病理学领域进行了专科培训。目前, Laura 是约翰霍普金斯大学医学院病理学系胃肠和肝病理学部门的副教授。她领导自己的基础科学实验室,专注于胰腺癌、导管内移植模型、监测、3D打印和胰腺癌前体病变的分子特征研究,同时还还负责胃肠病理学服务的临床标本鉴定。
参考文献
Braxton AM, Kiemen AL, Grahn MP,Forjaz A, Parksong J, Mahesh Babu J, Lai J, Zheng L, Niknafs N, Jiang L, ChengH, Song Q, Reichel R, Graham S, Damanakis AI, Fischer CG, Mou S, Metz C,Granger J, Liu XD, Bachmann N, Zhu Y, Liu Y, Almagro-Pérez C, Jiang AC, Yoo J,Kim B, Du S, Foster E, Hsu JY, Rivera PA, Chu LC, Liu F, Fishman EK, Yuille A,Roberts NJ, Thompson ED, Scharpf RB, Cornish TC, Jiao Y, Karchin R, Hruban RH,Wu PH, Wirtz D, Wood LD. 3D genomic mapping reveals multifocality of humanpancreatic precancers. Nature. 2024 May 1. doi: 10.1038/s41586-024-07359-3.Epub ahead of print. PMID: 38693266.
链接:http://www.lewenyixue.com/2024/05/14/Nature%20%EF%BD%9C%203D%E5%9F%BA%E5%9B%A0%E7%BB%84%E5%9B%BE%E8%B0%B1%E6%98%A0%E5%B0%84%E6%8A%80%E6%9C%AF/