刷新ES-SCLC一线治疗OS记录的四药联合方案获得NMPA批准!
摘要
2024年5月9日,PD-L1抑制剂贝莫苏拜单抗(benmelstobart)获得中国国家药品监督管理局(NMPA)批准上市,联合安罗替尼、卡铂和依托泊苷用于广泛期小细胞肺癌(ES-SCLC)患者的一线治疗。本次获批主要基于吉林省肿瘤医院程颖教授牵头开展的Ⅲ期ETER701研究结果。值得关注的是,该四药联合方案是目前同类研究已公布数据中无进展生存期(PFS)和总生存期(OS)最长的治疗方案。

ETER701研究回顾
研究设计
贝莫苏拜单抗是我国自主研发的一款全新序列的创新人源化抗PD-L1单克隆抗体,可阻止PD-L1与T细胞表面的PD-1和B7.1受体结合,使T细胞恢复活性,从而增强免疫应答,被认为具有多种肿瘤的治疗潜力。
2023年世界肺癌大会(WCLC)上公布的多中心、安慰剂对照的随机Ⅲ期ETER701临床试验,旨在评估贝莫苏拜单抗联合安罗替尼、卡铂和依托泊苷四药联合方案一线治疗ES-SCLC患者的疗效和安全性。双重主要终点为IRC评估的OS和PFS,次要终点包括研究者评估的PFS、客观缓解率(ORR)、疾病控制率(DCR)、缓解持续时间(DOR)、安全性和耐受性等。

图. ETER701研究设计
研究结果
四药联合组和单纯化疗组分别纳入246例和247例患者,基线特征相当。相较于单纯化疗组,四药联合组刷新了ES-SCLC一线治疗的OS,带来了更优的生存获益:中位OS分别为19.32个月 vs 11.89个月(HR=0.61, P=0.0002),中位PFS分别为6.93个月 vs 4.21个月(HR=0.32,P<0.0001)。
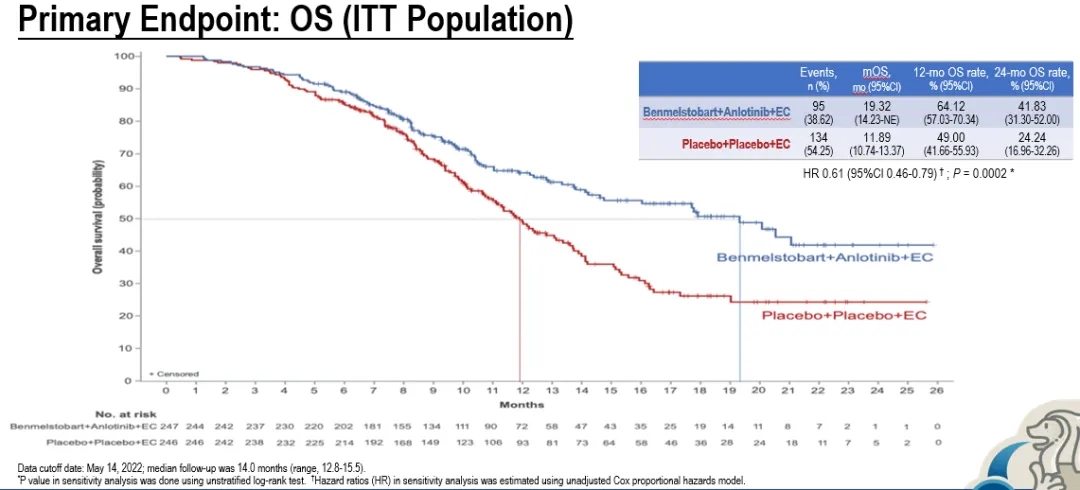
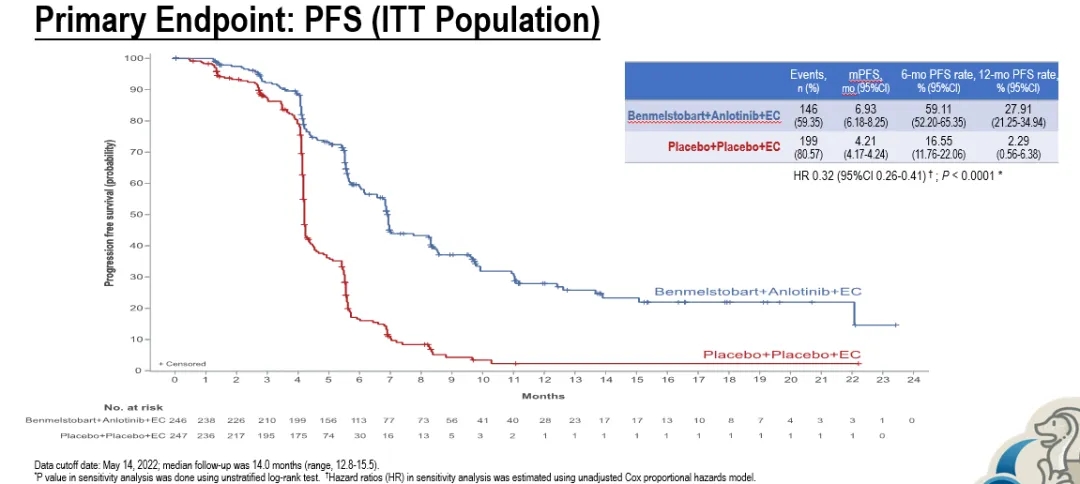
图. ETER701研究OS和PFS
次要终点方面,四药联合组 vs 单纯化疗组的
- ORR分别为81.30%和66.80%;
- DCR分别为90.65%和87.04%;
- 中位DOR分别5.75个月和3.09个月(HR=0.31,P<0.0001)。
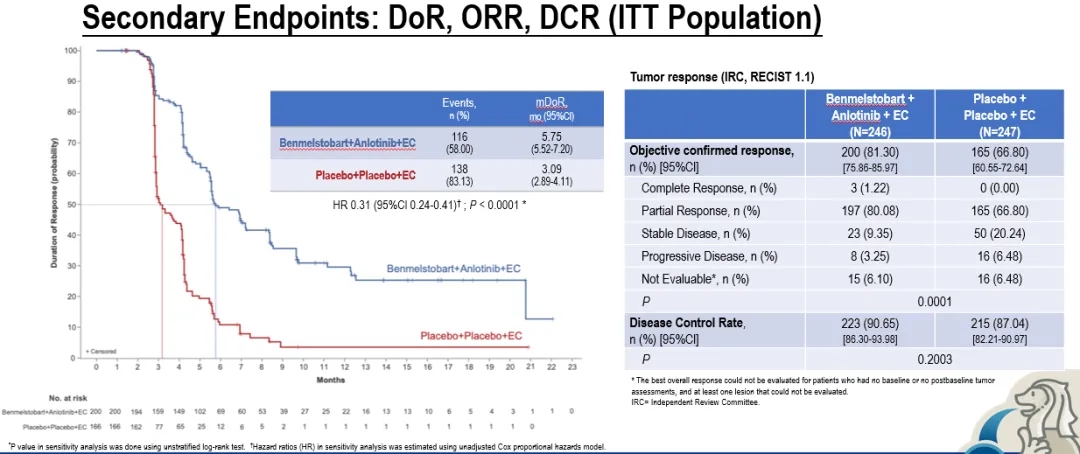
图. ETER701研究次要终点
- 安全性方面,两组在≥3级治疗相关不良事件(TRAE)的发生率为93.1%相似,整体安全性良好,未见新发安全性信号。

图. ETER701研究安全性
总结
ETER701研究标志着免疫治疗联合化疗基础上增加抗血管药物治疗模式在ES-SCLC治疗中的首次成功。相较于单纯化疗,贝莫苏拜单抗联合安罗替尼及化疗一线治疗ES-SCLC展现出卓越的临床获益,刷新了目前史上最长的中位PFS及中位OS记录,安全性整体可耐受,是2023年SCLC新药研究领域最耀眼的突破。该项研究提示在打压肿瘤细胞的同时,重塑肿瘤细胞赖以生存的微环境,可以进一步延长患者的生存期。相信随着贝莫苏拜单抗的获批和指南的肯定,ES-SCLC患者将迎来更优的一线治疗选择。
除了ES-SCLC,贝莫苏拜单抗与安罗替尼联用治疗复发性或转移性子宫内膜癌的适应证也已于2024年2月申报上市,并被国家药品监督管理局药品审评中心(CDE)纳入优先审评审批程序。期待贝莫苏拜单抗在肿瘤领域造福更多中国患者!
参考文献
Cheng Y, Yang R, Chen J, et al. Benmelstobart with anlotinib plus chemotherapy as first-line therapy for ES-SCLC: a randomized, double-blind, phase III trial (ETER701). 2023 WCLC. Abs OA01.03.
链接:http://www.lewenyixue.com/2024/05/14/%E5%88%B7%E6%96%B0ES-SCLC%E4%B8%80%E7%BA%BF%E6%B2%BB%E7%96%97OS%E8%AE%B0%E5%BD%95%E7%9A%84%E5%9B%9B%E8%8D%AF/