STTT | 中科大教授发现抗淋巴管生成药可促进药物在肿瘤积累
撰文:如日中天
IF=39.3
推荐度:
亮点:
本文作者描述了一种有前途的策略来改善治疗药物在肿瘤部位的积累。抗肿瘤淋巴管生成不仅提高了治疗药物的抗肿瘤疗效,而且有效抑制肿瘤转移,因此显示出与其他主流治疗方式联合治疗的巨大潜力。
中国科学院大学张银龙和国家纳米科学中心聂广军教授课题组在国际知名期刊 Sig Transduct Target Ther 在线发表题为 “Anti-lymphangiogenesis for boosting drug accumulation in tumors” 的论文。
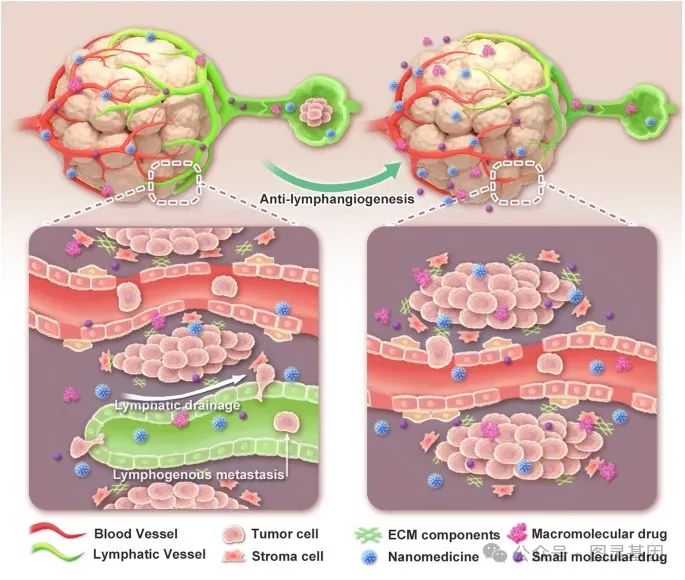
抗癌药物的肿瘤积累不足是目前治疗药物的一大缺点,在纳米药物的临床前景中仍然是一个更为重要的问题。在临床前研究中,已经探索了各种旨在调节治疗药物瘤内通透性的策略,主要关注血管调节和基质减少。然而,这些方法可能会触发或促进肿瘤转移作为权衡。因此,迫切需要创新策略,在不影响治疗结果的情况下促进肿瘤内药物积累。
作为除脉管系统和基质外影响药物肿瘤积累的另一个重要因素,肿瘤相关淋巴管( LVs )的影响尚未得到广泛考虑。在目前的研究中,作者验证了具有抗淋巴管生成活性的酪氨酸激酶抑制剂安洛替尼和选择性 VEGFR-3 抑制剂 SAR131675 有效降低了小鼠癌症模型中肿瘤淋巴管的密度,进一步增强了肿瘤组织中的药物积累。
图 1. 抗肿瘤淋巴管生成后治疗药物在瘤内的积累示意图
通过将安洛替尼与治疗药物(包括阿霉素( Dox )、脂质体阿霉素( Lip-Dox )和抗 PD-L1 抗体)联合使用,作者观察到与单药治疗方案相比,抗肿瘤疗效有所改善。同时,该策略显著减少了肿瘤转移并引发了更强的抗肿瘤免疫反应。该工作描述了一种新的、临床上可转移的方法来增加肿瘤内药物的积累,该方法显示出在不引入转移风险的情况下解决治疗药物当前不令人满意的疗效的巨大潜力。
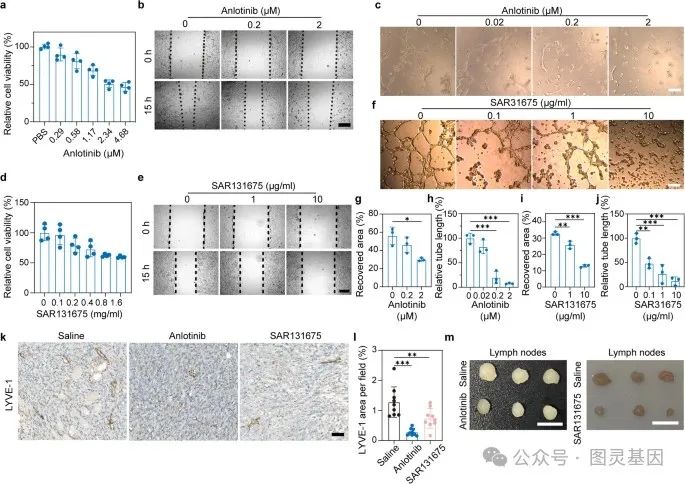
1 、安洛替尼和 SAR131675 的抗淋巴管生成活性
为了评估安洛替尼对淋巴内皮细胞( LEC )增殖的影响,作者将人淋巴内皮细胞( hLECs )在不同剂量的安洛替尼存在下孵育 24 小时。使用 CCK-8 测量,安洛替尼以剂量依赖性方式抑制 hLECs 的增殖( Fig. 2a )。此外,伤口愈合试验的结果表明,安洛替尼可以抑制 hLECs 的迁移( Fig. 2b, g ),用安洛替尼处理后, hLECs 的肾小管网络形成被打断( Fig. 2c, i )。同样, SAR131675 对 hELCs 增殖表现出剂量依赖性的抑制作用( Fig. 2d )和扰动迁移( Fig. 2e, h )和肾小管网络形成( Fig. 2f, j) )的 hLECs 。总的来说,这些体外结果表明,安洛替尼和 SAR131675 都可以通过抑制 hLECs 的增殖、迁移和小管网络形成来抑制淋巴管生成。
图 2. 安洛替尼和 SAR131675 在体内外的抗淋巴管生成活性
接下来,作者测试了两种药物的体内抗肿瘤淋巴管生成活性。携带 4T1 肿瘤的小鼠连续 10 天接受生理盐水、安洛替尼或 SAR131675 治疗。肿瘤切片中淋巴管标志物 LYVE-1 的免疫组织化学染色显示,安洛替尼或 SAR131675 治疗后淋巴管密度明显降低( Fig. 2k, l )。此外,安洛替尼或 SAR131675 治疗组的肿瘤引流淋巴结( LN )体积明显小于生理盐水组( Fig. 2m )。
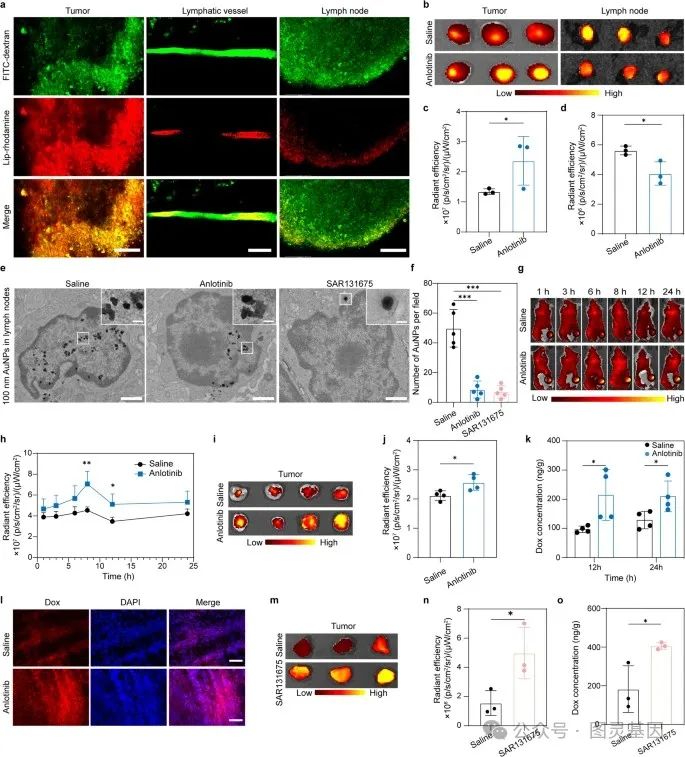
2 、肿瘤相关淋巴管的引流功能
利用多光子显微镜,作者观察到肿瘤内的 FITC- 右旋糖酐可以有效地退出肿瘤,并熟练地标记肿瘤周围的 LVs 。同时,作者观察到染料标记的纳米颗粒通过 LVs 离开肿瘤,最终进入附近的引流 LNs(Fig. 3a) 。随后,作者将脂质体局部注射到接受生理盐水或安洛替尼治疗的小鼠的肿瘤组织中。然后在注射后 8h ,通过手术分离肿瘤和引流的 LNs 进行荧光成像。安洛替尼治疗小鼠肿瘤组织的荧光信号明显强于盐水处理组。相比之下,安洛替尼处理组引流的 LNs 的荧光信号明显弱于生理盐水处理组 (Fig. 3b – d) ,,表明抑制淋巴管生成有助于增强纳米颗粒的瘤内保留。
图 3. 纳米颗粒从肿瘤引流到 LNs 的减少,增强淋巴管生成抑制后肿瘤内纳米颗粒或游离阿霉素的积累
值得注意的是,透射电镜图像显示,在使用安洛替尼和 SAR131675 治疗后,进入引流的 LNs 的 AuNPs 数量明显减少 (Fig. 3e, f) 。这些数据表明,在肿瘤内积累的物质可以被肿瘤相关的 LV 排出,而抗淋巴管生成治疗有助于增强瘤内滞留。
抗淋巴管生成治疗后,肿瘤内纳米颗粒、大分子和小分子药物的积累增强。使用体内成像系统( IVIS )在不同的时间点监测和定量纳米颗粒的瘤内积累,安洛替尼治疗组在肿瘤中表现出更高的纳米颗粒积累 (Fig. 3g – j )。作者进一步评估了安洛替尼治疗对小分子药物瘤内积累的影响。小鼠提前接受生理盐水或安洛替尼治疗,并静脉注射游离阿霉素。在给药后 12 和 24 h ,用带有荧光检测器的高效液相色谱仪( HPLC )检测肿瘤匀浆中阿霉素的浓度。数据显示,安洛替尼治疗小鼠的肿瘤组织中阿霉素的浓度几乎是盐水处理小鼠的两倍 (Fig. 3k, l) 。
采用 SAR131675 进一步验证了抗淋巴管生成治疗后肿瘤药物瘤内积累增强的现象。如图 3m-o 所示,与生理盐水组相比,用 SAR131675 处理的小鼠肿瘤中游离 Dox 和 Lip-Cy5.5 的含量增加。综上所述,安洛替尼和 SAR131675 介导的抗淋巴管生成治疗均可显著增加多种药物制剂的肿瘤积累,包括纳米颗粒、大分子和小分子药物。
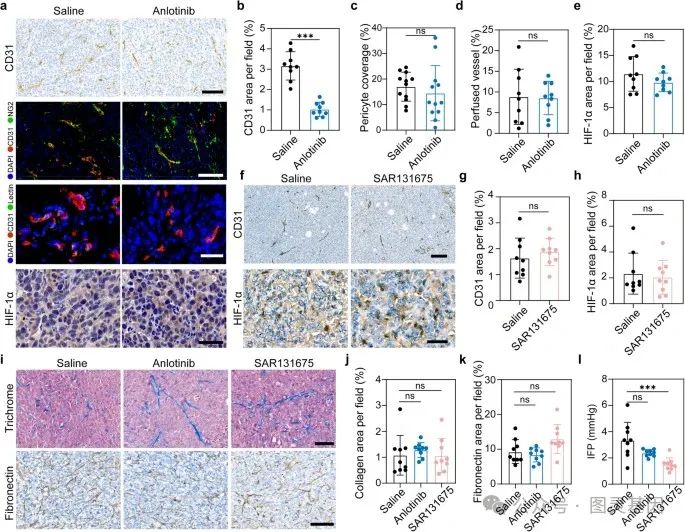
3 、安洛替尼和 SAR131675 对肿瘤血管和肿瘤间质的影响
接下来,作者研究了在所使用的实验剂量下,使用安洛替尼或 SAR131675 治疗是否可以诱导血管系统正常化。在用安洛替尼治疗的小鼠中,肿瘤切片的血管标记物 CD31 的免疫组化染色显示肿瘤血管密度降低 (Fig. 4a, b) 。为了评估肿瘤血管系统的结构完整性,作者对肿瘤组织进行了 CD31 和周细胞标记物 NG2 的免疫荧光染色。获得的图像显示,与生理盐水治疗相比,安洛替尼治疗并没有增加肿瘤部位血管的周细胞覆盖范围 (Fig. 4a, c) ,这说明安洛替尼并不能促进肿瘤血管的成熟。接下来,作者通过静脉注射 DyLight@488 标记的凝集素来评估肿瘤血管灌注。与生理盐水组相比,安洛替尼治疗并没有增加 CD31 + lectin + 血管的比例 (Fig. 4a, d) 。
图 4. 安洛替尼和 SAR131675 对肿瘤血管、肿瘤间质和 IFP 的结构和功能的影响
肿瘤血管正常化的另一个重要指标是缺氧的减轻,因此作者继续通过免疫组化染色来评估肿瘤组织中 HIF-1 α的表达。同样,治疗组和对照组之间没有显著差异 (Fig. 4a, e) 。综上所述,这些结果表明,安洛替尼并不能改善肿瘤血管的结构和功能,其对肿瘤血管系统的影响也不能促进上述物质的瘤内积累。
在经 SAR131675 处理的小鼠中,与生理盐水处理的小鼠相比,肿瘤血管密度没有显著的变化 (Fig. 4f, g) ,而肿瘤缺氧的缓解也没有被观察到 (Fig. 4f, h) 。此外,考虑到安洛替尼的多靶点效应,作者对肿瘤间质和间质液压力( IFP )进行了综合评估,这是影响治疗药物在肿瘤组织中的分布和渗透的两个关键因素。作者首先通过马森三色染色法和免疫组化染色评估了胶原蛋白和纤维连接蛋白的水平,这是肿瘤间质的两个关键成分。结果显示,安洛替尼和 SAR131675 对肿瘤间质均无任何影响 (Fig. 4i – k) 。此外,与盐处理组相比,安洛替尼治疗组的肿瘤 IFP 没有显著变化,而 SAR131675 处理小鼠的肿瘤 IFP 下降 (Fig. 4l) 。
4 、脂质体阿霉素和阿霉素联合安洛替尼的疗效增强
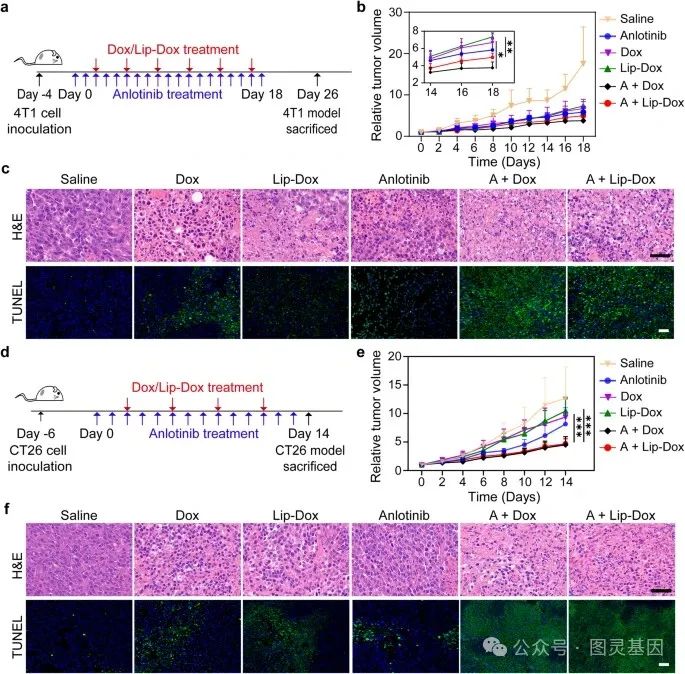
荷瘤小鼠随机分为 6 组:生理盐水、安洛替尼、阿霉素、脂质体阿霉素、安洛替尼 + 阿霉素( A + 阿霉素)和安洛替尼 + 脂质体阿霉素( A + 脂质体阿霉素)。当肿瘤体积达到 ~100 mm 3 时,每天腹腔注射生理盐水或安洛替尼,共注射 10 次。接下来,每三天静脉注射一次生理盐水、阿霉素或脂质体阿霉素。 4T1-luc 肿瘤模型治疗的实验时间线如图 5a 所示。
图 5. 当阿霉素和脂质体阿霉素(等效剂量: 3 mg/kg) 联合安洛替尼( 1.5 mg/kg )治疗小鼠 4T1-luc 和 CT26 异种移植瘤模型的疗效改善
联合治疗组( A + 阿霉素组和 A + 脂质体阿霉素组)表现出的抗肿瘤活性明显高于任何单一治疗组 (Fig. 5b) 。与肿瘤生长曲线一致, H&E 分析和 TUNEL (脱氧核苷酸转移酶介导的缺口末端标记)染色显示,与单药治疗组相比, A + 阿霉素组和 A + 脂质体阿霉素组的肿瘤表现出更大的核染色质凝结和碎片,以及更强的 TUNEL 信号(图 5c )。对于 CT26 肿瘤模型,实验时间轴如图 5d 所示,阿霉素、脂质体阿霉素和安洛替尼治疗的抗肿瘤疗效均有限。令人鼓舞的是,阿霉素或脂质体阿霉素与安洛替尼联合使用可导致更大的肿瘤抑制率 (Fig. 5e) ,可能是由于安洛替尼治疗后阿霉素和脂质体阿霉素的肿瘤积累增强。此外, H&E 分析和 TUNEL 染色显示,联合治疗组的肿瘤组织出现了更多的细胞凋亡和坏死 (Fig. 5f) ,提示其抗肿瘤疗效有所提高。
5 、安洛替尼的免疫调节作用
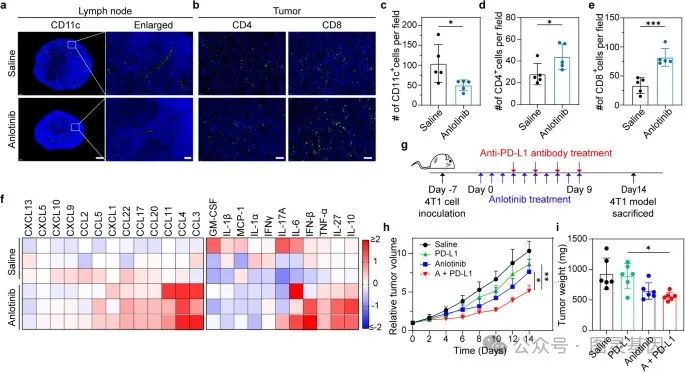
考虑到安洛替尼的抗血管生成和抗淋巴管生成活性,作者接下来评估了安洛替尼对抗肿瘤免疫的影响,以及它对抗 PD-L1 抗体在 4T1 荷瘤小鼠模型中的治疗疗效的影响。与预期一致,在肿瘤引流的 LNs 中, CD11c 的免疫荧光染色显示,安洛替尼治疗减少了 LNs 中的 DC 数量 (Fig. 6a, c) ,这可能与肿瘤相关 LVs 的密度降低有关。然而,在安洛替尼治疗后,肿瘤内 CD4+ 和 CD8+ T 细胞的浸润增加 (Fig. 6b, d, e) ,与之前的报告一致。
图 6. 安洛替尼可调节抗肿瘤免疫,提高抗 PD-L1 检查点封锁的治疗效果
为了进一步评估肿瘤内免疫反应的变化,作者检测了肿瘤匀浆中各种趋化因子和细胞因子的浓度。如图 6f 所示,在安洛替尼处理的小鼠中,几种趋化因子的水平,包括 T 细胞和 NK 细胞招募相关的趋化因子 CCL4 、 CCL20 和 CCL3 的水平升高。同时,在安洛替尼治疗后,一些促炎细胞因子,如 TNF- α和 IL-6 ,在安洛替尼治疗后的浓度也升高。综上所述,这些数据表明,安洛替尼治疗可以将肿瘤转化为一种免疫“热”状态。
结合安洛替尼对肿瘤免疫微环境的影响和肿瘤内抗 PD-L1 抗体的积累,作者接下来评估了安洛替尼加抗 PD-L1 抗体对 4T1 肿瘤模型的治疗效果。治疗时间线如图 6g 所示。单独使用抗 PD-L1 抗体的抗肿瘤疗效有限,而联合使用策略的抗肿瘤效果显著 (Fig. 6h) 。任何治疗组的体重均无明显下降。在治疗结束时,记录切除的肿瘤组织的重量,反映了与肿瘤生长曲线相同的趋势 (Fig. 6i) 。
6 、安洛替尼的抗转移作用
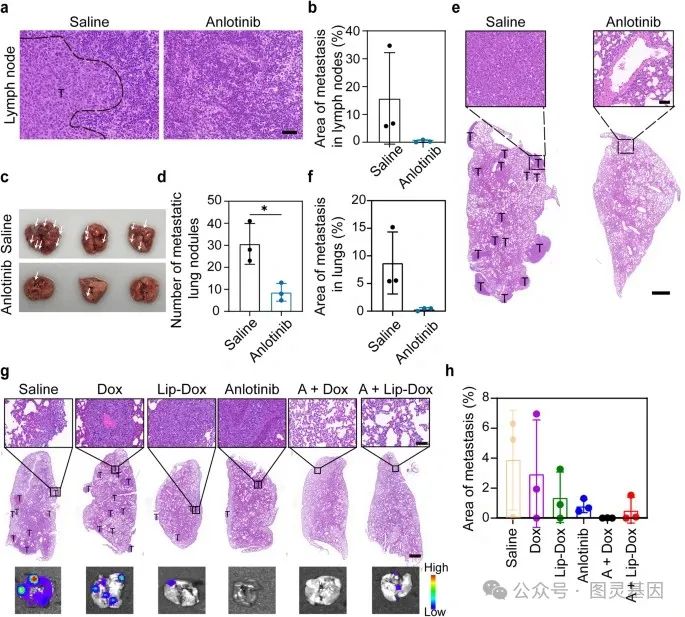
在本研究中,作者进一步研究了安洛替尼在小鼠 4T1 乳腺肿瘤模型中的抗转移活性。荷瘤小鼠连续 10 天每天给予生理盐水或安洛替尼。当生理盐水组肿瘤体积达到 2000 mm 3 后,处死小鼠。采集腹股沟 LNs 和肺。如图 7a 、 b 所示,生理盐水组的引流 LNs 有大面积的转移灶,而安洛替尼组的引流 LNs 没有明显的肿瘤定植。由于肺组织是 4T1 肿瘤转移的优先器官,作者收集了小鼠的肺以进行进一步的组织学分析。图 7c , d 中的肺图像显示,安洛替尼组的转移性病变数量少于生理盐水组。 H&E 染色也证实了这些结果 (Fig. 7e, f) 。
图 7. 安洛替尼对小鼠 4T1 肿瘤模型的抗转移疗效
此外,作者在 4T1-luc 肿瘤模型的组合治疗实验中观察到了肺转移。最后一次治疗后 8 天,小鼠腹腔注射 D- 荧光素钾盐。收集肺,用 IVIS 检测 4T1-luc 肿瘤细胞的生物发光,观察转移灶。作者还对肺组织进行了 H&E 染色,以进一步检查转移灶。如图 7g , h 所示,含安洛替尼的治疗组对转移有明显的抑制作用,这表明生物发光强度和转移面积降低。综上所述,这些结果表明,安洛替尼阻断了引流 LNs 中的肿瘤定植,并阻止了远端转移。
7 、结论
本文作者描述了一种有前途的策略来改善治疗药物在肿瘤部位的积累。抗肿瘤淋巴管生成不仅提高了治疗药物的抗肿瘤疗效,而且有效抑制肿瘤转移,因此显示出与其他主流治疗方式联合治疗的巨大潜力。
教授介绍
张银龙是中国科学院大学纳米药物合成及生物医学应用副教授,博士生导师。研究方向为 1. 抗血小板药物改性及纳米逆转剂开发; 2. 疾病治疗微纳机器人。利用多学科交叉(生物学,药学,材料学,化学,医学),致力于制备功能纳米药物,对多种疾病进行治疗,解决临床面临的科学问题。
聂广军教授就职于国家纳米科学中心。聂教授的研究小组旨在开发以纳米生物技术为动力的智能药物载体、治疗诊断平台和机器人纳米器件,能够应对复杂和动态的生物微环境,并在体内具有高安全性、可靠性和有效性。通过利用纳米材料的巨大设计和多功能灵活性,他们渴望在分子、细胞和全身水平上精确操纵生物过程,为针对癌症、心血管问题和免疫疾病等疾病的新疗法铺平道路。他们研究的最终目标是弥合尖端纳米技术与未满足的临床需求之间的差距。
参考文献
Wang C, Xu J, Cheng X, Sun G, Li F, Nie G, Zhang Y. Anti-lymphangiogenesisfor boosting drug accumulation in tumors. Signal Transduct Target Ther. 2024Apr 15;9(1):89. doi: 10.1038/s41392-024-01794-4.
链接:http://www.lewenyixue.com/2024/04/30/STTT%20%7C%20%E4%B8%AD%E7%A7%91%E5%A4%A7%E6%95%99%E6%8E%88%E5%8F%91%E7%8E%B0%E6%8A%97%E6%B7%8B%E5%B7%B4%E7%AE%A1%E7%94%9F%E6%88%90/









赶快来坐沙发