Nat Biotech | 超低成本基因合成技术助力个体化TCR发现,上交校友呈源生物团队技术行业领先
日前,荷兰癌症研究中心(Netherlands Cancer Institute, NKI)的WouterScheper、Ton Schumacher课题组与呈源生物(RootPath)团队合作在《自然-生物技术》(Nature Biotechnology, IF = 68.2)上发表题为“Discovery of tumor-reactive T cell receptors by massively parallel librarysynthesis and screening”的研究论文,展示了呈源生物独有的超高通量基因合成技术如何助力个体化TCR药物的发现。该论文详尽分析了呈源生物超高通量DNA片段组装的准确性、基于基因合成和二代测序的TCR功能筛选的可行性和灵敏度、以及研究人员如何使用此技术深化对T细胞基因表达谱的解读。呈源生物联合创始人陈曦博士作为共同通讯作者领导了此项研究。来自深圳第一人民医院、中山大学肿瘤防治中心和纽约大学(New York University)的研究人员也参与了本次研究。
在很多实体瘤中,肿瘤发生和增大的的直接原因是肿瘤浸润性T细胞(也称为肿瘤浸润性淋巴细胞,tumor-infiltratinglymphocytes或TILs)杀死肿瘤细胞的速度赶不上肿瘤细胞增殖的速度。因此,如何提高TILs的数量或功能已成为当前免疫肿瘤学研究的重点。其手段包括使用药物(如检查点抑制剂、细胞因子等)或在体外培养TILs后再回输到患者体内。这些研究方向中的一个主要障碍是,TILs由多种多样的T细胞组成,其中真正能识别并杀死肿瘤的T细胞往往只占少数,而其他细胞仅仅是“旁观者”。而且,TILs中的肿瘤识别性T细胞经常处于耗竭和功能障碍(dysfunctional)状态,这使得对这些T细胞的鉴定或富集难上加难。
为了解决这个问题,呈源生物(RootPath)和NKI的联合研究团队开发了一项新技术,通过大规模并行测序和合成TILs中的T细胞受体(TCR)基因,创建了多克隆合成型TILs(polyclonal synthetic TILs)。这类合成型TILs整合了由TCR基因赋予的肿瘤识别能力和新鲜T细胞的优秀细胞状态。利用这些合成TILs,研究人员可以有效地发现能识别肿瘤抗原的TCR基因,并有望利用这些TCR基因为实体瘤患者创建个性化的细胞疗法。
在免疫肿瘤学研究中,评价一个T细胞的两个最重要指标是:(1)其T细胞受体(TCR)是否能识别肿瘤抗原,以及(2)这个细胞是否拥有足够健康的细胞状态,使其在接触并识别肿瘤细胞后执行增殖和杀伤功能。简单地说就是T细胞是否具有“正确的心智”和“强健的体魄”。然而在TILs中,这两者往往不会在同一个T细胞中共存。随着测序技术有尤其是是单细胞RNA测序技术(single cell RNA-Seq, scRNA-Seq)的快速发展,研究人员可以轻易地从成千上万个TILs中获取 a - b 配对的TCR序列。这些序列决定了T细胞的“心智”。然而这些序列只是数字化的“蓝图”,并不是可以放入其他T细胞(例如来自同一患者的,具有“强健体魄”的新鲜T细胞)中的DNA分子。把蓝图变成DNA分子则需要基因合成。虽然大规模合成TCR基因理论上是可行的,但利用当前的技术,每个TCR基因的成本要达到近100美元。因此,对成千上万个TCR基因进行合成往往在经济上是不现实的。呈源生物和NKI的研究人员开发了一种新的序列设计算法,使他们能够利用价格极其低廉的寡核苷酸池(oligopool)组装出 a - b 正确配对的,全长的TCR基因,使得合成一个TCR基因的物料成本降至1美元。研究人员进一步证明,这些TCR基因可以被引入到新鲜的T细胞中并正确发挥功能。并且当结合了基于二代测序(NGS)的新型筛选技术后,研究人员可以迅速有效地从TILs群体中寻找到 “正确的心智”,即可以肿瘤抗原的TCR基因。
RootPath联合创始人兼首席执行官、该研究共同通讯作者陈曦博士表示:“这项工作有力地展示了合成生物学进步如何能够为癌症研究和癌症治疗带来更好的工具。”对于公司未来的计划,陈曦博士说:“我们正在不断发展更便宜、更快速的基因合成和筛选技术,并将逐步将它们开放给我们的客户。RootPath的使命是在未来大约10年内,将基因合成的成本降低1-2个数量级,将基因功能鉴定的通量提高1-2个数量级。这篇论文是我们在这一旅程中的一个重要里程碑。”
来自荷兰NKI的研究员、文章的共同通讯作者Wouter Scheper博士表示:“在研究像T细胞群体这样的复杂体系的时候,测序并合成是可以带来非常清晰的数据。我们2019年在《自然-医学》上的论文已经展示了这一点。但当时我们只能合成几十个TCR。通过RootPath在基因合成技术上的创新,我们已经可以把这一手段的通量提高100倍。我相信这项技术可以为人们对T细胞的理解以及基于T细胞的创新药开发提供催化剂。”
呈源生物在2023年底已经发布了呈源定制基因库,将基因合成的成本降低到了每碱基人民币¥0.2-0.3元,不到市场上现行价格的一半。陈曦博士表示他们将很快商业化提供本篇论文中报道的TCR基因合成和筛选服务,并补充说一些早期测试客户已经使用了这项服务并获得了满意的结果。
关于呈源生物:
呈源生物(RootPath)是一家专注于基因合成和解码免疫系统的合成生物学和细胞治疗公司。呈源生物成功开发了世界首个基于超高通量DNA片段组装的长序列基因合成技术和多克隆、多功能TCR-T细胞生产技术,同时率先将这些技术应用于合成免疫学平台,助力开创新一代个体化、多克隆、肿瘤反应性T细胞疗法。呈源生物于2017年由巢生资本孵化创立,至今共获得融资近7000万美元,投资人包括红杉资本、经纬创投、鼎晖投资、云九资本、火山石资本、元禾原点等。
文章简介
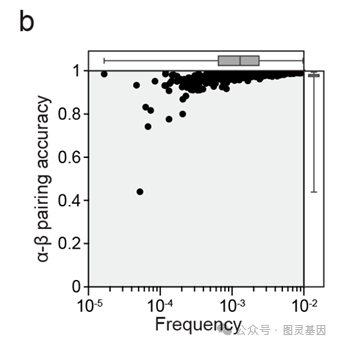
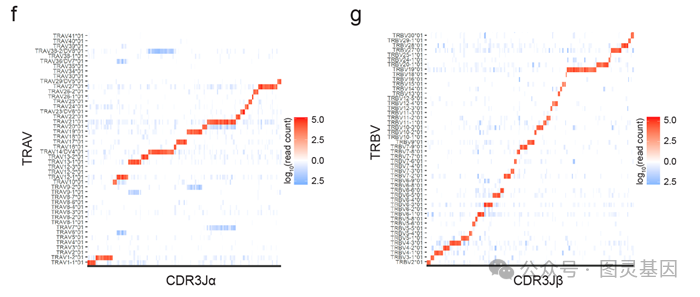
为了极限降低TCR基因合成的成本,研究人员利用了TCR基因不经历“体细胞超变异”(somatic hypermutation,这点与B细胞的BCR即抗体基因不同)这一特点,事先合成好了人类群体中常见的50 – 70个TRBV与TRAV基因的L-FR1-CDR1-FR2-CDR2-FR3区段,并将其制备成单链DNA池(ssDNA TRAV_GL Pool和ssDNA TRBV_GL Pool)。这些单链DNA池可以被重复利用。为每一组TCR基因(包括约1000个TCR),研究人员分别订购寡聚核苷酸池ssDNA CDR3 a pool和ssDNA CDR3 b pool,并利用其分别具备的Zip和Zip*互补序列,在均一溶液中将两组寡聚核苷酸池定向连接。由于每个TCR所对应的Zip序列不同,而且不同Zip序列高度正交,研究人员通过NGS证明了此平行连接高度准确(不同TCR基因的准确率中位数为98.2%,见图1b)。研究人员还通过“密码子多样性化(codon-persified)”的FR3区段序列实现了CDR3 a 和TRAV_GL的准确连接(见图1f)以及CDR3 b 和TRBV_GL的准确连接(见图1g)。
图1a :“一锅法”TCR 基因组装流程。
图1b :ssDNA CDR3 apool 和ssDNA CDR3 bpool 之间的正交连接高度准确
图1f-g :CDR3 a 和TRAV_GL 的连接(f )以及CDR3 b 和TRBV_GL 的连接高度准确。
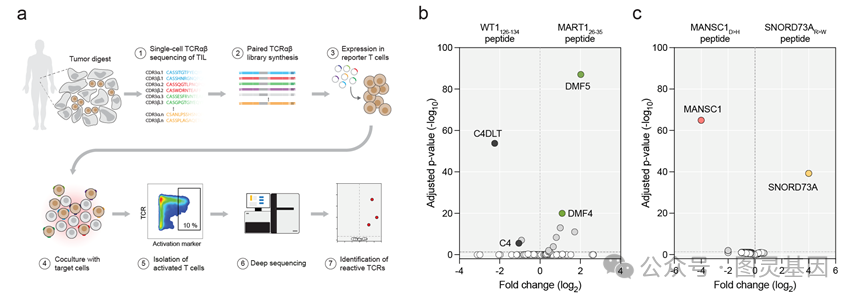
验证了TCR基因合成的准确性后,研究人员将TCR基因以“一锅法”形式导入工具T细胞中(工具T细胞可以是Jurkat细胞也可以是病人或健康捐赠者的外周血T细胞)形成“多克隆TCR-T”细胞,并将此多克隆TCR-T细胞与负载了肿瘤抗原的抗原呈递细胞共培养12到24小时。带有识别肿瘤抗原的TCR的工具T细胞会在此过程中被激活,并上调激活标志物(如CD69和CD137)。用FACS筛选这些激活标志物上调的T细胞后,研究人员用高通量测序检测了每个TCR在这些被筛选的T细胞中的比例。如果比例显著上升则该TCR很可能识别该肿瘤抗原。利用文献中报道过的或实现验证过的阳性对照TCR及其对应的抗原,研究人员证明了这些TCR可以有效地从带有~1000个TCR基因的文库中被发现(图2a-c)。研究人员接着证明了此技术可以从卵巢癌、宫颈癌、肝癌病人的TIL样品中发现全新的识别新生抗原、病毒抗原以及未知抗原的TCR。
图2a-c :(a )高通量TCR 功能筛选流程。(b-c )负载了野生型(b )或突变型(c )的抗原多肽的抗原呈递细胞可以有效富集识别这些多肽-MHC 复合物的TCR 。
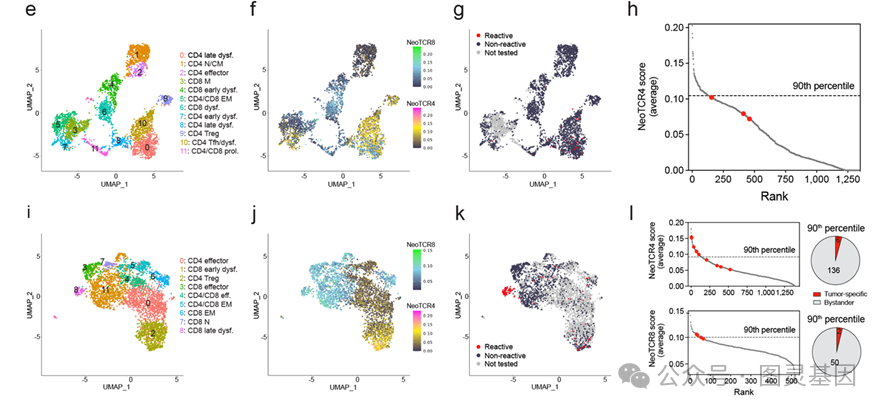
近年来,一些基于在微孔或液滴中对于单个T细胞的TCR mRNA进行反转录和PCR扩增的方法也被用来克隆TCR。相比于这些方法,本文中介绍的新方法的一个独特之处是可以与单细胞转录组测序配合使用,在得知某一TCR识别抗原能力的同时,研究者可以同时知道原始TIL细胞中带有这一TCR的细胞的转录组状态。这一特性可以用来验证近年来不同研究组提出的基因表达指纹(geneexpression signature)与T细胞的肿瘤识别性的关系。例如,研究者检查了病人样品中T细胞的NeoTCR4和NeoTCR8指纹(该指纹由美国国家癌症研究中心National Cancer Institute的Steven Rosenberg实验室提出)分数与其携带的TCR的肿瘤识别能力的相关性(图4e-l)。
图4e-l :病人样品中T 细胞的NeoTCR4 和NeoTCR8 指纹分数与其携带的TCR 的肿瘤识别能力的相关性。
链接:http://www.lewenyixue.com/2024/04/26/Nat%20Biotech%20%7C%20%E8%B6%85%E4%BD%8E%E6%88%90%E6%9C%AC%E5%9F%BA%E5%9B%A0/






赶快来坐沙发