ADC详解系列第三期——连接子篇
前言
抗体偶联药物(ADC)是通过“连接子(linker)”将具有细胞毒性的药物(有效载荷)偶联至抗体组合而成的“生物子弹”,由靶点、抗体、连接子、载荷和偶联方式五个要素组成,每一部分对ADC的作用都至关重要,但今天我们把目光放在连接抗体和载荷的连接子上,看看人们对连接子的探索到了何种程度。
前文回顾:
连接子的特征
对ADC药物来说,连接子需要承担两个任务:首先,它要保证ADC在血液中有较好的稳定性;其次,它要保证ADC能精准地将载荷在目标位置释放。
因此,要求连接子具有以下3个特点:
第一,连接子的稳定性好,可以维持ADC在血液循环中的药物浓度,并在细胞毒性药物到达靶点之前不会释放,从而导致最小的脱靶效应,提高ADC药物的安全性;
第二,连接子允许在内化后在目标部位快速释放有效载荷;
第三,连接子合适的亲水性/亲脂性可以增强有效载荷结合和降低免疫原性的特性 [1] 。
连接子的分类
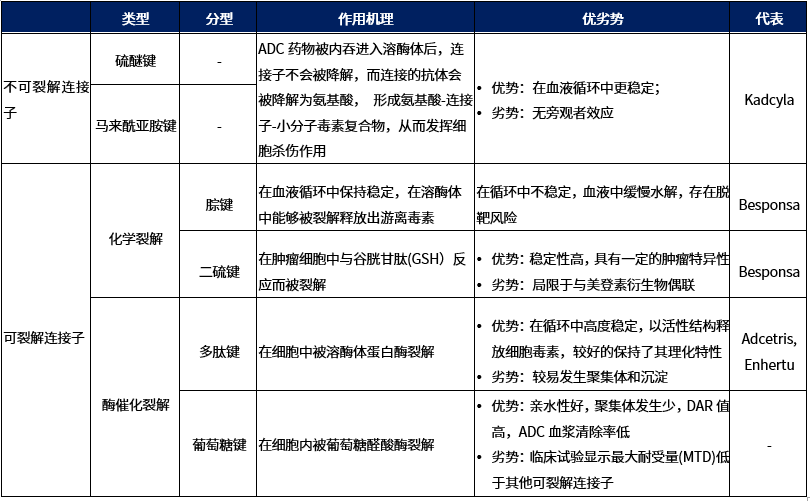
ADC的连接子分为两种类型:不可裂解连接子和可裂解连接子(表1)。不可裂解连接子表示在胞内新陈代谢过程中连接子保持完整。带有这种连接子的ADC需要抗体的溶酶体降解才能释放有效载荷;可裂解连接子是指连接子在胞内新陈代谢中可分裂,会产生含有该细胞毒剂的代谢物,该代谢物可能会具有部分连接子 [2] 。
表1. 连接子的分类
不可裂解的连接子特点
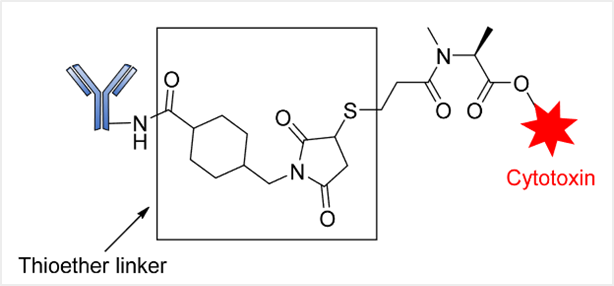
不可裂解连接子分为两类,即硫醚或马来酰亚胺基己酰基(MC),它们由稳定的键组成,防止蛋白水解裂解(图1)。这种类型连接子的ADC依赖于溶酶体酶降解来释放内化后的有效载荷,从而导致连接子的同时分离 [3] 。
基因泰克/Immunogen公司早期已经成功探索这种连接子的应用,如用于治疗人表皮生长因子受体2(HER2)阳性转移性乳腺癌的ADC药物——曲妥珠单抗emtansine(T-DM1或Kadcyla ® ),该ADC含有不可裂解的SMCC(N-琥珀酰亚基-4-(马来酰亚甲基)环己烷-1-羧酸)连接子,将DM1细胞毒素连接到曲妥珠单抗上。
可裂解连接子特点
1. 化学裂解的连接子
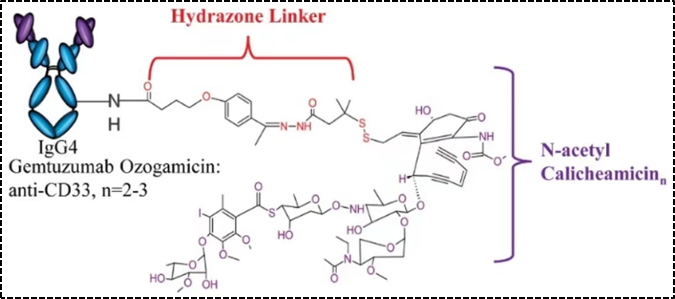
图2. Mylotarg的结构示意图
另外一类是可还原的连接子——二硫键,二硫键具有还原型谷胱甘肽依赖性,与血浆(∼5μmol/L)中相比,细胞质中谷胱甘肽的水平较高(1–10 mmol/L),因此还原型二硫键连接子在血液循环中相对稳定,在细胞内谷胱甘肽还原裂解二硫键连接子以释放有效载荷。
2. 酶裂解的连接子
与化学不稳定的连接子不同,酶裂解的连接子利用细胞中独特的高浓度水解酶来切割并释放药物,在控制药物释放方面取得了临床成功。
第一类是多肽类连接子,主要包括二肽连接子和四肽连接子。多肽类连接子裂解的机制是ADC通过内吞作用和运输到溶酶体进行内化后,组织蛋白酶B选择性地裂解该连接子,从而释放有效载荷。
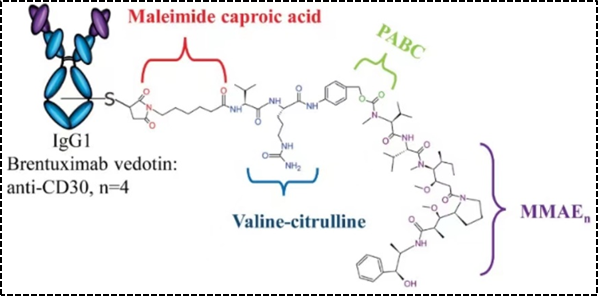
已上市ADC药物中应用最多的二肽连接子包括Val-Cit和Val-Ala二肽,两种连接子的稳定性、细胞活性相当。但由于沉淀和聚集,Val-Cit很难实现高DAR,相比之下,Val-Ala连接子可以使DAR高达7.4,但聚合有限(<10%)。与Val-Cit相比,Val-Ala具有较高的亲水性,因此这种连接子在亲脂性有效载荷的背景下更具有优势,比如PBD-二聚体。采用上述二肽连接子的已上市ADC药物包括Adcetris(图3)、Polivy、Padcev和Disitamab Vedotin(RC48)等 [4] 。
图3. Adcetris结构示意图
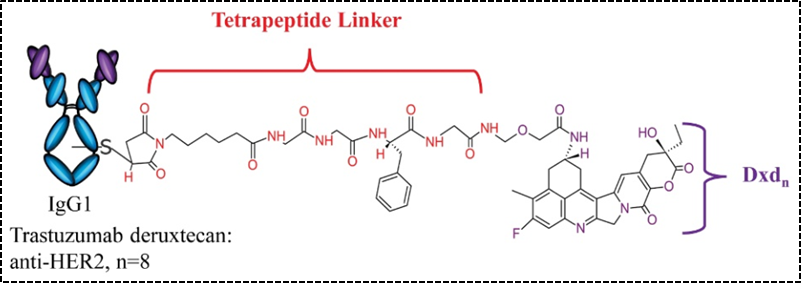
除了二肽连接子,四肽Gly-Gly-Phe-Gly也成功应用于ADC药物,与二肽相比,四肽连接子在血液循环中更加稳定,已上市的ADC药物Enhertu(图4)使用了此类连接子,恒瑞公司即将上市的靶向HER-2的ADC药物SHR-A1811也是采用的上述四肽连接子。
图4. Enhertu结构示意图
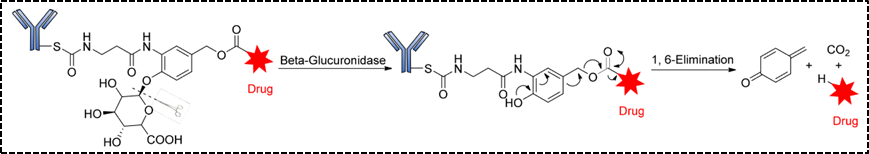
第二类酶裂解连接子是葡萄糖苷酶类连接子,主要包括β-葡萄糖苷酶连接子和β-半乳糖苷酶连接子。β-葡萄糖醛酸酶敏感的ADC是通过将β-葡萄糖苷酶连接子与自消除的PABC间隔分子共价结合细胞毒性药物和抗体上。与β-葡萄糖醛酸酶类似,β-半乳糖苷酶在某些肿瘤中过表达,在肿瘤中它水解β-半乳糖苷键,释放药物,不同的是,β-半乳糖苷酶仅存在于溶酶体中,而β-葡萄糖醛酸酶在溶酶体中表达,也在实体瘤的微环境中表达 [5] 。
图5. β-葡萄糖醛酸酶连接子结构及释放机制
总结
连接子会影响ADC的稳定性、毒性、药代动力学特性和药效学,因此在ADC设计中会很谨慎地选择相应的连接子。同时,新型连接子的开发正稳步向前,未来将进一步丰富ADC的设计策略,以进一步提高ADC的临床价值。
ADC详解系列第四期——载荷篇
参考文献:
[1] Tsuchikama K, An Z. Antibody-drug conjugates: recent advances in conjugation and linker chemistries. Protein Cell. 2018 Jan;9(1):33-46.
[2] Sheyi R, de la Torre BG, Albericio F. Linkers: An Assurance for Controlled Delivery of Antibody-Drug Conjugate. Pharmaceutics. 2022 Feb 11;14(2):396.
[3] Kostova V, Désos P, Starck JB, Kotschy A. The Chemistry Behind ADCs. Pharmaceuticals (Basel). 2021 May 7;14(5):442.
[4] Dean AQ, Luo S, Twomey JD, Zhang B. Targeting cancer with antibody-drug conjugates: Promises and challenges. MAbs. 2021 Jan-Dec;13(1):1951427.
[5] Su Z, Xiao D, Xie F, Liu L, Wang Y, Fan S, Zhou X, Li S. Antibody-drug conjugates: Recent advances in linker chemistry. Acta Pharm Sin B. 2021 Dec;11(12):3889-3907.
* 此文仅用于向医学人士提供科学信息,不代表本平台观点
链接:http://www.lewenyixue.com/2024/04/26/ADC%E8%AF%A6%E8%A7%A3%E7%B3%BB%E5%88%97%E7%AC%AC%E4%B8%89%E6%9C%9F%E2%80%94%E2%80%94%E8%BF%9E%E6%8E%A5%E5%AD%90%E7%AF%87/





赶快来坐沙发