外泌体定义了健康胰腺和胰腺导管腺癌的局部和全身通讯网络

胰腺导管腺癌 (PDAC) 是一种致命疾病,需要掌握其生物学才能进行有效治疗。与癌症有关的外泌体在生命系统中知之甚少。在这里,我们使用基因工程小鼠模型(ExoBow)来绘制来自体内健康和PDAC胰腺的外泌体的时空分布,以确定其生物学意义。我们发现,在PDAC微环境中,癌细胞通过外泌体与癌症相关的成纤维细胞和内皮细胞建立了优先的通讯途径。后者是健康胰腺中的保守事件。在这两种情况下抑制外泌体分泌都会增强血管生成,强调它们对血管形成和癌症的贡献。在PDAC中,器官间通讯显着增加,特定器官是外泌体通讯的最常见靶标,在健康中的胸腺、骨髓、大脑和肠道,以及PDAC中的肾脏、肺和胸腺。总之,我们发现外泌体介导有组织的胰腺内和胰腺间通讯网络,具有体内调节作用。
胰腺导管腺癌 (PDAC) 是胰腺癌的主要形式,其特点是晚期和有限的治疗选择,导致预后严峻,诊断后平均生存时间仅为 6 个月。尽管付出了巨大的努力,但我们目前对PDAC生物学的理解并没有转化为患者预后的显着改善。迄今为止,用于确定潜在治疗途径的方法和策略取得了有限的突破,因此迫切需要对PDAC复杂的生物学的新见解,以改善患者护理。
细胞间通讯在维持体内平衡和协调疾病过程方面起着关键作用。细胞间通讯的关键介质之一是细胞外囊泡 (EV),据信所有细胞类型都会释放这些囊泡。EV 包含两个主要亚类,即外泌体和微囊泡。外泌体是 30-150 nm 的纳米大小囊泡,起源于内吞途径,而微囊泡直接从质膜萌芽,大小可达几微米。外泌体已成为促进肿瘤进展的各种生物过程中的主要贡献者。这些囊泡富含四跨膜蛋白,如 CD63、CD81 和 CD9,并通过多泡小体与质膜对接和融合后的胞吐作用事件释放,这一过程由 Rab27a 介导。因此,Rab27a对于携带CD63等内体标志物的外泌体和囊泡的分泌是必不可少的。
外泌体通过其货物对靶细胞产生影响,这些货物包括蛋白质、DNA、RNA、脂质和代谢物,通过内吞作用或与受体细胞的质膜直接融合递送。此外,外泌体可以参与受体-配体相互作用以调节靶细胞。据推测,外泌体的影响涉及广泛的过程,包括免疫反应调节、肿瘤微环境 (TME) 重塑、血管生成、癌细胞的迁移和侵袭以及转移前生态位的建立。然而,由内源性产生的外泌体建立的通讯路线在很大程度上仍未被探索。由外泌体介导的局部和器官间通讯的直接证据仍然是一个悬而未决的问题,外泌体在多细胞生物体中的生物学意义在很大程度上是未知的。因此,我们的目标是揭示PDAC和健康胰腺中外泌体的胰腺内和器官间时空分布模式,以揭示其生物学意义和潜在的治疗靶点。
为了实现这一目标,我们开发了一种外泌体标记报告系统ExoBow,能够在体内对CD63阳性外泌体(CD63 Exos)进行组织和细胞类型特异性跟踪。本研究全面剖析了自然分泌的胰腺外泌体局部(胰腺内)和全身(器官间)的时空分布。将ExoBow小鼠与成熟的PDAC模型相结合,我们确定了健康胰腺和PDAC细胞建立的通信途径。
3.1谱系追踪外泌体的 ExoBow 模型
我们设计了一种基因工程小鼠模型(GEMM)ExoBow来追踪自然产生的外泌体,以确定外泌体的时空分布及其生物学意义。首先,团队通过一系列实验明确了CD63是一个理想的标志物来标记胰腺源性外泌体和ExoBow转基因在胰腺细胞中有效重组,并设计了Flp或Flp/Cre依赖的ExoBow报告员,该报告员生成标记的CD63+外泌体,而不干扰CD63蛋白的细胞定位或外泌体分泌。
ExoBow转基因(R26CD63-XFP/+)是一种双重组酶驱动模型(Cre和翻转酶-Flp),可以以靶器官或细胞类型为条件(图1a)。转基因盒被设计为插入ROSA26位点的内含子1中,并由CAG启动子控制。在CD63开放阅读框的上游放置了一个由Frt位点两侧的STOP盒,以防止其表达。小鼠CD63序列之后是四种不同的荧光蛋白:mCherry,phiYFP,eGFP和mTFP,它们的两侧是不同的和不相容的lox重组位点(LoxN,Lox2272和Lox5171)。在Flp重组时,去除STOP盒会导致标记分泌外泌体的CD63-mCherry融合蛋白(CD63-mCherry+)的表达。在同一细胞中的额外Cre重组导致mCherry的去除和CD63-phiYFP、CD63-eGFP或CD63-mTFP融合蛋白(CD63-XFP+)的表达。
体内成像显示,在 Pdx1 胰腺特异性启动子 (Pdx1-Flp;R26CD63-XFP/+以下简称Panc-CD63-mCherry),导致胰腺中出现强烈的 mCherry 荧光(图 1b)。免疫荧光分析进一步证实了胰腺细胞中的高效重组和CD63-mCherry表达(图1c)。将Panc-CD63-mCherry小鼠模型胰腺中的EV分离成小型EV和大型EV。发现CD63-mCherry在小EVs部分富集,这表明CD63-mCherry在外泌体亚群中富集(图1d)。将Pdx1-Flp;R26CD63-XFP/+模型交叉到额外的Pdx1-Cre驱动线允许在单个胰腺细胞中将eGFP、phiYFP或mTFP随机融合到CD63(CD63-XFP)(Panc-ExoBow,图1e)。高倍显微镜的仔细研究表明,CD63-XFP定位于细胞中的小囊泡和质粒膜结构中(图1f)。我们观察到胰腺细胞的聚集,其中所有细胞都表达相同的荧光蛋白融合(图1f),如预期的那样支持重组干细胞/祖细胞的共同起源。在从胰腺分离的囊泡中检测到所有CD63-XFP融合蛋白,再次富集较小的EVs部分,这是外泌体亚群的特征(图1g)。
总之,我们证明 ExoBow 是一种多功能的转基因模型,可以有效地标记健康胰腺或 PDAC 中胰腺细胞中分泌的 CD63 外泌体,而不会破坏正常的胰腺发育或疾病进展。
3.3外泌体介导的胰腺内通讯由靶向内皮细胞和癌相关成纤维细胞的特定途径定义
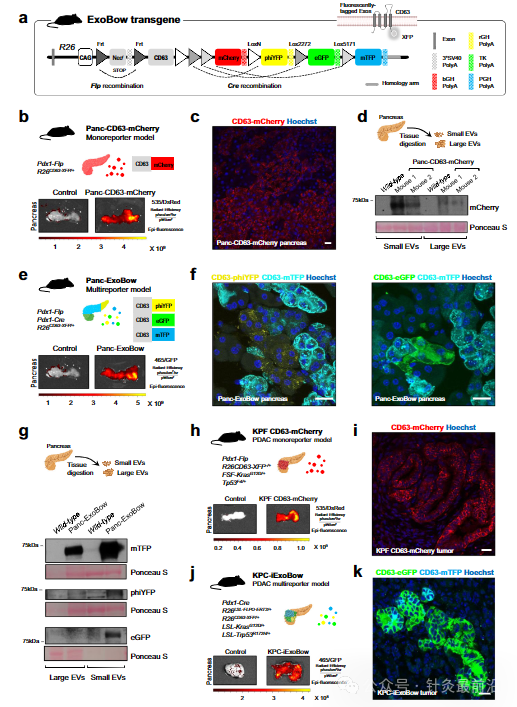
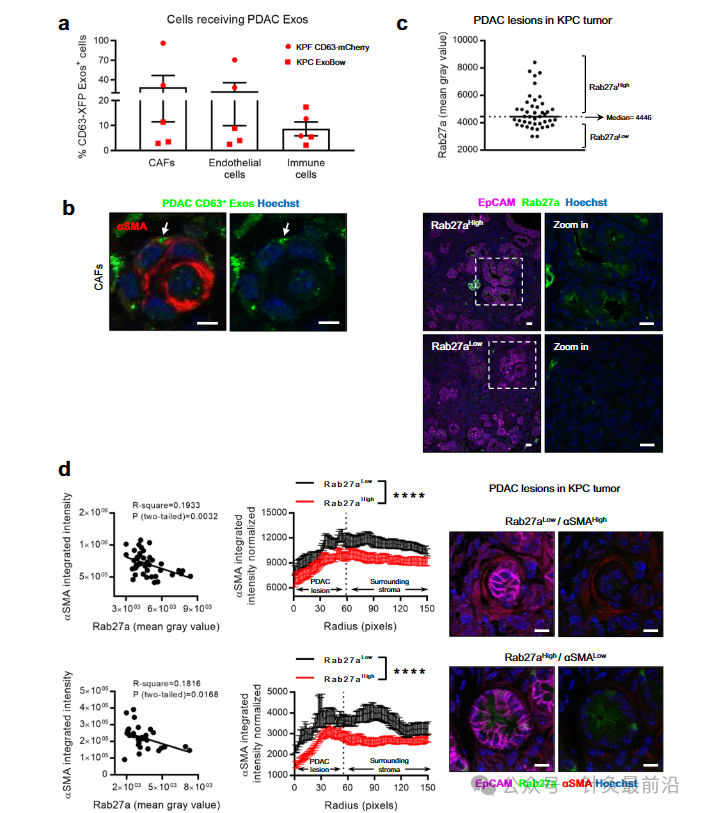
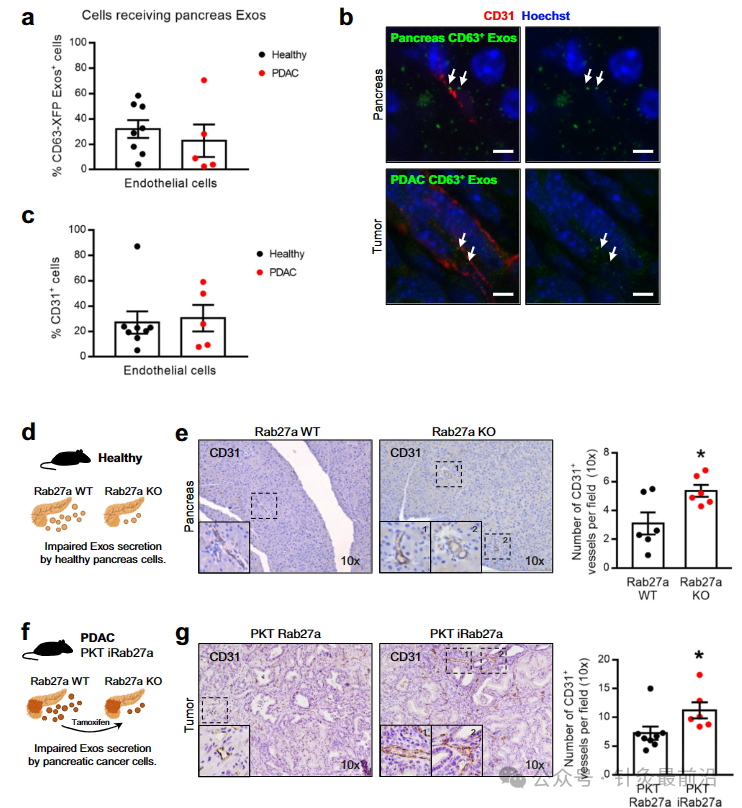
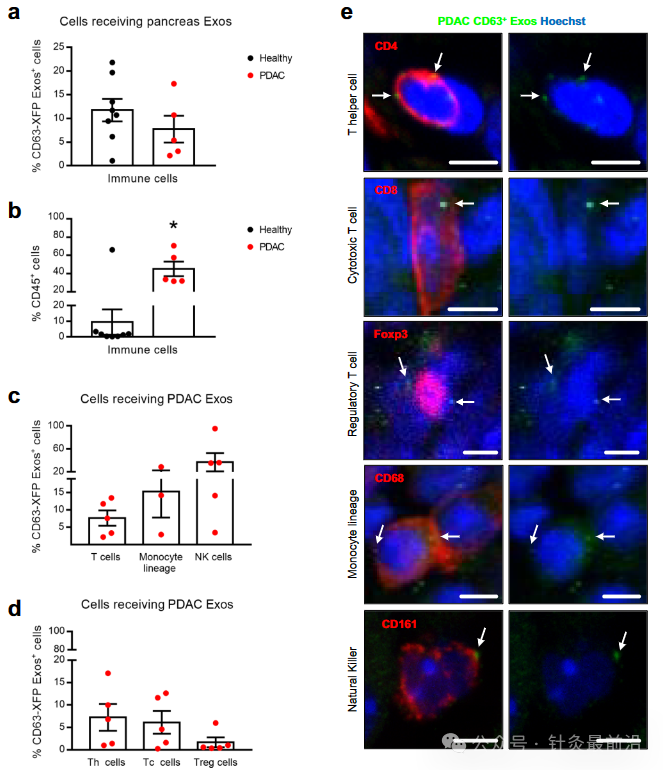
PDAC微环境表现出强大的结缔组织增生反应,其特征是细胞数量超过癌细胞的数量。我们发现癌症相关成纤维细胞 (CAF)、内皮细胞和免疫细胞在 KPF CD63-mCherry 和 KPC-ExoBow 小鼠的肿瘤中接受 PDAC CD63 Exos(图 2a)。与CAFs(CD140A和α-平滑肌肌动蛋白阳性,αSMA)和内皮细胞(CD31;图2a,b)的交流比与免疫系统细胞(CD45)的交流更频繁,这是由CD63 Exos阳性细胞的百分比决定的。有趣的是,通信率,由CD63 Exos阳性细胞的数量与肿瘤中的患病率来定义,并不依赖于它们的频率。我们发现,PDAC中的通信模式不是细胞亚型数量的直接函数(图2a)。考虑到αSMA CAFs在PDAC进展中的预后意义,我们研究了与这些细胞的通讯如何影响它们在TME中的数量或空间分布。我们首先观察到KPC肿瘤中的PDAC病变呈现Rab27a表达的异质模式,Rab27a是外泌体分泌的替代标记(图2c)。接下来,我们证明有效分泌外泌体的PDAC病变(Rab27aHigh)被αSMALow CAFs包围,通常与炎症表型相关,而Rab27alow的PDAC病变被αSMAHigh CAFs28包围(图2d)。这种反向相关性表明外泌体可以将CAFs调节为炎症表型并影响其在PDAC肿瘤中的空间分布。
3.4外泌体介导的器官间通讯在PDAC中得到增强,并在癌症中与胸腺、肾脏和肺形成特定的通讯途径
比较所有器官的荧光总体水平,与健康胰腺相比,PDAC在外泌体介导的器官间通讯中表现出显着增加(图5a)。具体而言,PDAC中CD63 Exos的通讯率增加了16倍,与健康胰腺相比,PDAC CD63 Exos检测呈阳性的器官增加了20%(图5b和补充图11a)。这种增加均匀地分布在不同的器官中,只有腋窝淋巴结 (AXL LN) 和肠道中段在健康的情况下更高(补充图11b)。通过绘制CD63 Exos在健康胰腺和PDAC中的器官间分布图,发现PDAC CD63 Exos主要在肾脏、胸腺和肺中持续积累(图5c)。虽然与PDAC相比相对较低,但在胸腺、大脑、股骨/骨髓和肠道的不同部分也检测到健康的胰腺CD63 Exos(补充图11c,d)。
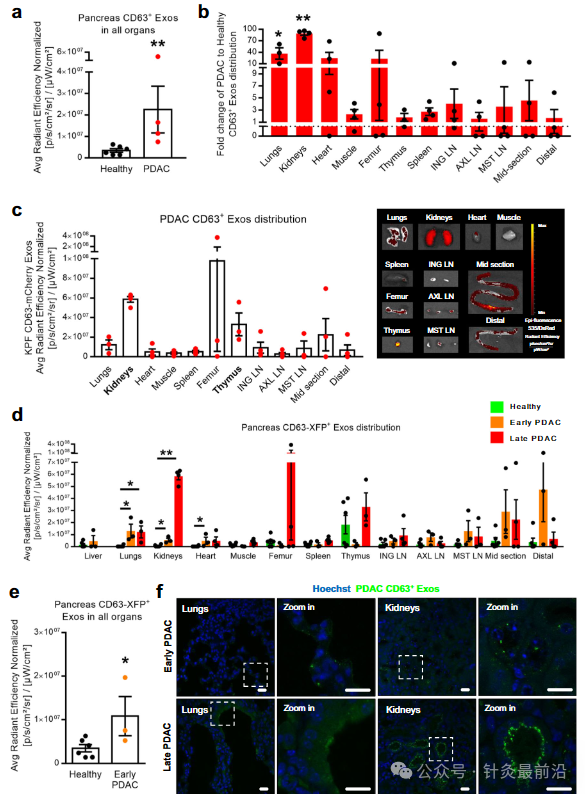
为了确定 CD63 Exos 在 PDAC、肺和肾脏中最常见的通讯位点的受体细胞类型,我们采用了这些器官中普遍存在的细胞群的细胞标记物。对于肾脏,我们检查了巨蛋白阳性细胞(近端小管)、水通道蛋白 2 阳性细胞(集合管)和平足蛋白阳性细胞(肾小球)。我们的观察表明,在早期和晚期PDAC阶段,近端小管(Megalin)是PDAC CD63 Exos的主要受体,其次是集合管(Aquaporin-2)(图6)。 有趣的是,肾小球(Podoplanin)在两种情况下都没有显示出PDAC CD63 Exos的阳性。这种免疫荧光模式与我们的IVIS评估一致,该评估表明,与疾病早期相比,晚期PDAC EVs积累增加(图5d、f 和图6a、b)。
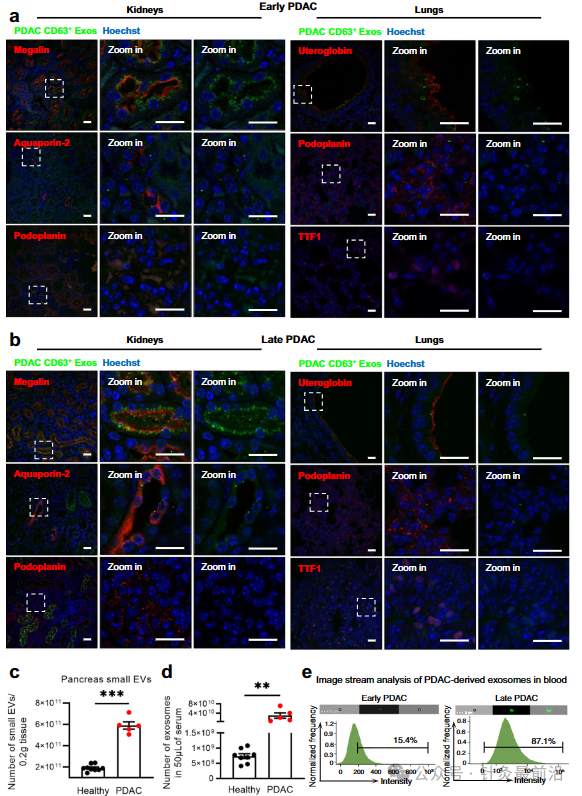
此外,还评估了来自健康和PDAC胰腺的小EV的数量,发现在癌症背景下小EV的富集(图6c)。与健康小鼠相比,这种趋势在携带PDAC的小鼠的循环中检测到的囊泡数量中很明显(图d)。重要的是,在PDAC小鼠的循环中检测到了PDAC CD63 Exos的存在,在PDAC后期的患病率更高(图6e)。这一观察结果与从PDAC早期到晚期PDAC阶段不同器官的CD63 Exos生物分布水平的增加相对应(图5d)。总的来说,这些结果有助于全面了解PDAC CD63 Exos建立的长距离细胞间通信网络及其潜在的生物学意义。总之,我们的研究提供了外泌体与来自健康胰腺和PDAC的远处器官进行体内交流的证据。我们证明,PDAC中的器官间通讯得到增强,并且不是一个随机事件,特别是在健康胰腺中的胸腺以及PDAC中的胸腺、肾脏和肺进行特定交流之后。
3.5PDAC小EV货物综合分析反映体内局部互连组
为了深入了解PDAC外泌体在摄取时影响受体细胞的机制,我们首先从健康的WT胰腺和KPC小鼠的肿瘤中分离出小EV,并进行了质谱分析(图7a)。分析显示,这两个小EV亚群共享了很大一部分货物(71%,图7b),可能表明共同的祖系和重叠的生物学功能。WT 和 KPC 小 EV 中血管生成相关蛋白的富集支持了这种比对(图 7c)。然而,WT和KPC小EV中29%的蛋白质组学含量是不同的,其中24%的检测到的蛋白质对KPC小EV具有特异性,只有5%对WT小EV具有特异性(图7b).这种差异表明,在癌症背景下,蛋白质库更加多样化,可能反映了更广泛的生物学作用,特别是在细胞活化途径中(图7d)。
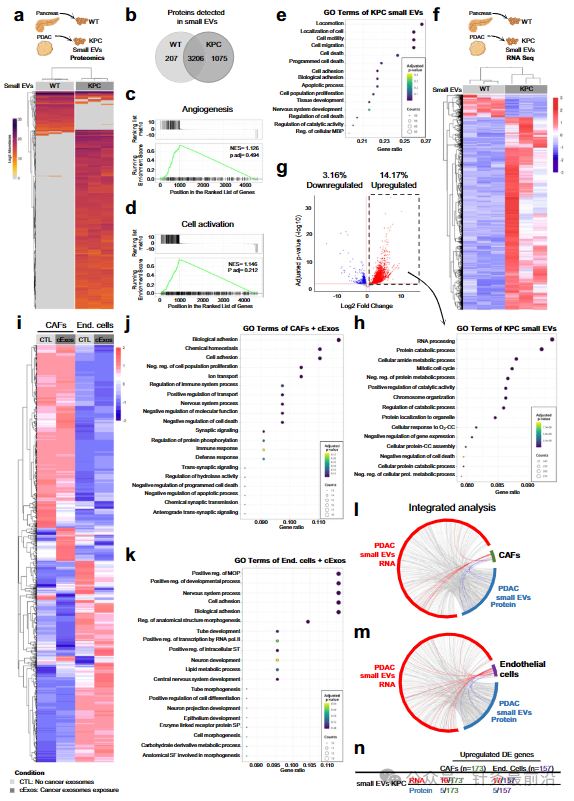
为了进一步了解PDAC CD63 Exos靶向的两种主要细胞类型中癌症外泌体摄取时发生的表型变化,将体外建立的CAFs细胞系和内皮细胞系(bEnd.3)暴露于癌症外泌体。暴露于癌症外泌体及其非暴露外泌体后的 CAF 和内皮细胞 (bEnd.3) 的 RNA Seq 分析揭示了一组差异表达基因 (图7i). 对用癌症外泌体治疗的CAF中上调基因的基因本体分析突出了与细胞分化、细胞粘附增加、细胞增殖减少、程序性细胞死亡和蛋白质代谢改变相关的途径(图7j)。这些发现反映了代谢重编程,已知代谢重编程会塑造不同的CAF行为并影响癌细胞的代谢转换和生长能力。
此外,还确定了与免疫反应调节相关的途径,可能与炎症或抗原呈递的CAF亚型有关(图7j)。在内皮细胞中,癌症外泌体治疗后下调基因的基因本体分析涉及与细胞粘附、分化和血管形成相关的基因(图7k)。这些发现共同说明了癌症外泌体对CAF和内皮细胞的调节能力,与PDAC GEMMs中观察到的表型一致(图2,3)。
最后,我们探讨了在CAF和内皮细胞中观察到的基因表达改变是否与KPC小EV的RNA和蛋白质货物直接相关。我们的分析证实了KPC小EV的RNA和蛋白质货物与暴露于癌症外泌体后CAF和内皮细胞中的差异表达基因之间的直接关联(图7l,m)。值得注意的是,与CAFs相比,内皮细胞中上调的差异表达基因的覆盖率更高(图7n),说明了货物从小EV到细胞的直接转移,以及这种内容传递的下游分子效应。
排版:郑雅蔓
初审:陈波
审核:郭永明
链接:http://www.lewenyixue.com/2024/04/10/%e5%a4%96%e6%b3%8c%e4%bd%93%e5%ae%9a%e4%b9%89%e4%ba%86%e5%81%a5%e5%ba%b7%e8%83%b0%e8%85%ba%e5%92%8c%e8%83%b0%e8%85%ba%e5%af%bc%e7%ae%a1%e8%85%ba%e7%99%8c%e7%9a%84%e5%b1%80%e9%83%a8%e5%92%8c%e5%85%a8/





赶快来坐沙发