新药速递丨FDA批准替雷利珠单抗单药治疗化疗后晚期或转移性ESCC
FDA已批准替雷利珠单抗(Tevimbra)用于既往全身化疗后且未接受过含PD-1/PD-L1抑制剂的全身治疗后的不可切除或转移性食管鳞状细胞癌(ESCC)成人患者的单药治疗[1]。
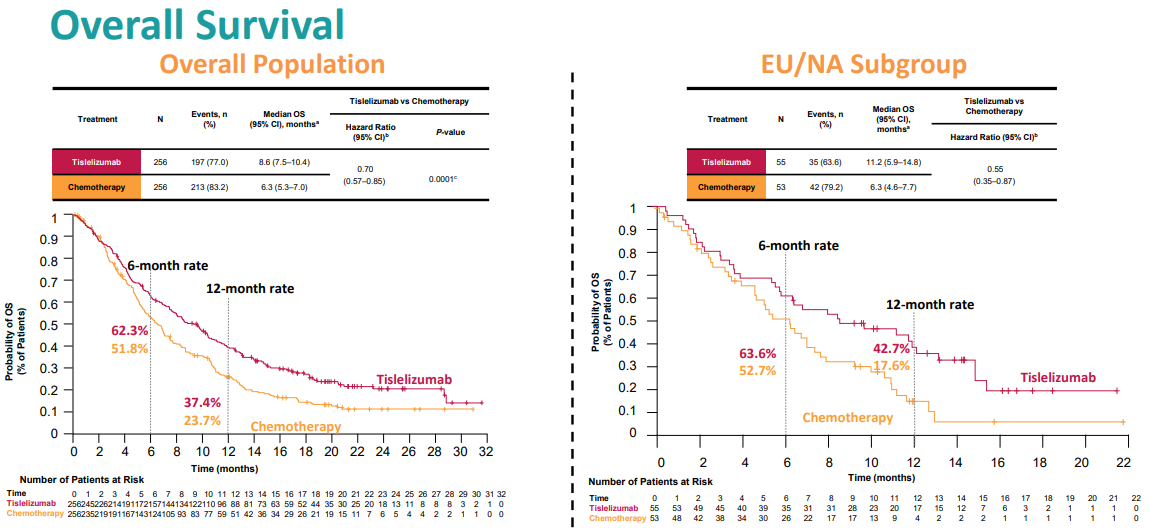
FDA做出这一批准是基于Ⅲ期研究RATIONALE 302(NCT03430843)的数据,该研究表明替雷利珠单抗(N=256)与化疗(N=256)相比显著改善了患者的总生存期(OS),中位时间分别为8.6个月(95%CI:7.5~10.4)和6.3个月(95%CI:5.3~7.0)(HR:0.70;95%CI:0.57~0.85;P=0.0001)。替雷利珠单抗组的6个月OS率为62.3%,化疗组为51.8%;12个月OS率分别为37.4%和23.7%。
替雷利珠单抗组VS.化疗组的OS
RATIONALE 302研究概况
一线全身治疗期间或之后出现疾病进展的晚期或转移性ESCC患者被纳入该Ⅲ期研究[2]。患者的ECOG体能状态要求为0或1。参与者(N=512)以1:1的方式随机分配到每3周静脉注射(IV)200 mg替雷利珠单抗组或研究者选择的化疗组。化疗组患者接受以下方案之一:紫杉醇135 mg/m2至175 mg/m2,每3周静脉注射或80 mg/m2至100 mg/m2,每周给药一次;多西紫杉醇75 mg/m2,每3周静脉注射一次;或伊立替康125 mg/m2第1天和第8天静脉注射,每3周一次。
分层因素包括地区(亚洲[不包括日本] VS.日本VS.欧洲/北美)、ECOG体能状态(0 VS. 1)和化疗选择(紫杉醇VS.多西他赛VS.伊立替康)。全随机人群中的OS是主要试验终点。次要终点包括无进展生存期(PFS)、总缓解率(ORR)、缓解持续时间(DOR)和安全性。
该研究需要大约400个死亡事件才能达到82%的功效,主要终点的显著性水平0.025(单侧)下检测HR为0.75。如果全随机人群中的OS被证明显著,则依次评估PD-L1联合阳性评分(CPS)≥10%的患者亚组的OS。
在2021年ASCO年会上公布的研究结果显示,替雷利珠单抗优于化疗的生存获益在包括PD-L1状态、种族和地区等预定义的亚组中均有报道。在PD-L1 CPS≥10%的患者中,替雷利珠单抗组的中位OS为10.3个月(95%CI:8.5~16.1),而化疗组为6.8个月(95%CI:4.1~8.3)(HR:0.54;95%CI:0.36~0.79;P=0.0006)。替雷利珠单抗组和化疗组的6个月OS率分别为67.4%和50.8%;12个月的OS率分别为44.0%和27.0%。
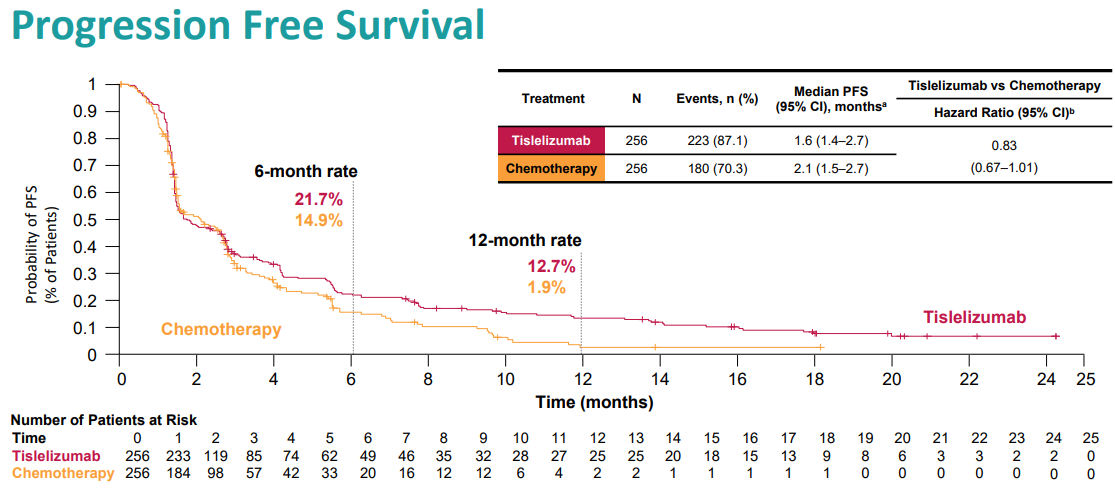
替雷利珠单抗组报告的中位PFS为1.6个月(95%CI:1.4~2.7),而化疗组为2.1个月(95%CI:1.5~2.7)(HR,0.83;95%CI:0.67~1.01)。这些组的6个月PFS率分别为21.7%和14.9%,12个月PFS率分别为12.7%和1.9%。PFS Kaplan~Meier曲线在随机分组后约3个月开始分离,且更有利于替雷利珠单抗组。
替雷利珠单抗组VS.化疗组的PFS
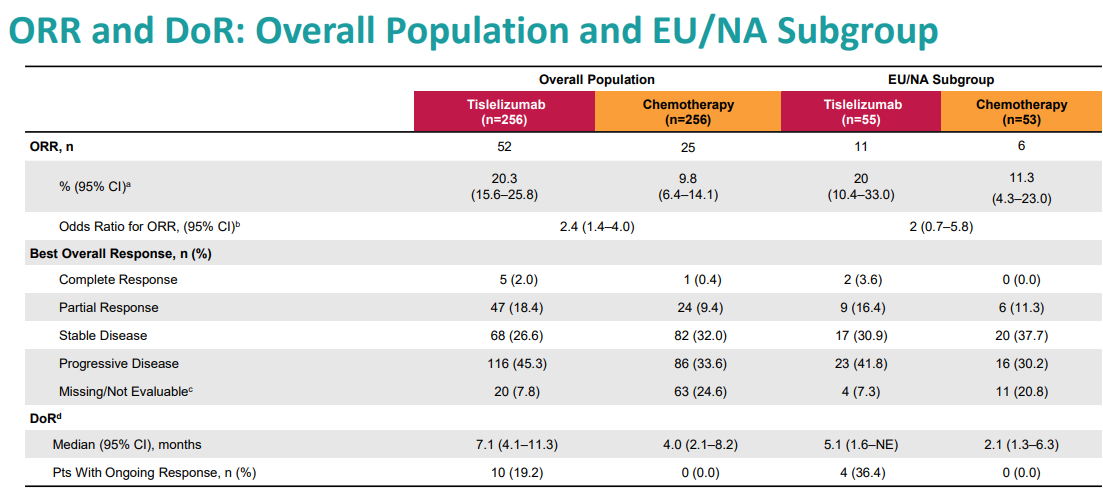
替雷利珠单抗的ORR也高于化疗组,分别为20.3%(95%CI:15.6%~25.8%)和9.8%(95%CI:6.4%~14.1%)(HR,2.4;95%CI:1.4~4.0)。此外,替雷利珠单抗组的中位DOR比化疗更长,分别为7.1个月(95%CI:4.1~11.3)和4.0个月(95%CI:2.1~8.2)。截至2020年12月1日,替雷利珠单抗组中19.2%的患者对治疗仍有反应,而化疗组则没有反应。
替雷利珠单抗组VS.化疗组的ORR和DoR
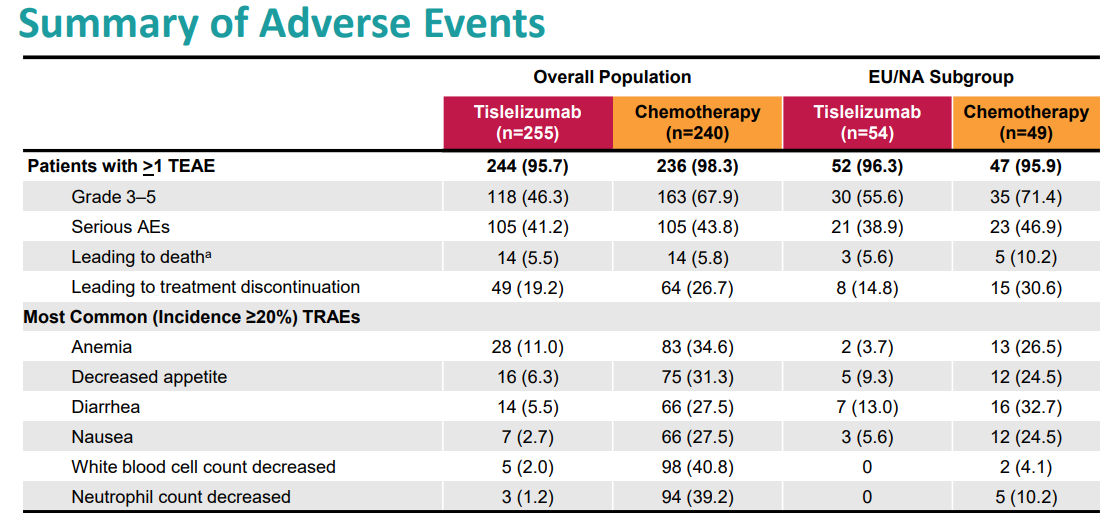
替雷利珠单抗的安全性
该药物最常见的毒副反应发生在>20%的患者中,包括血糖升高、血红蛋白降低、淋巴细胞减少、钠降低、白蛋白降低、碱性磷酸酶升高、贫血、疲劳、天冬氨酸氨基转移酶升高、肌肉骨骼疼痛、体重减轻、丙氨酸氨基转移酶升高和咳嗽等。
替雷利珠单抗的安全性
替雷利珠单抗的“获批之路”
2021年9月,FDA接受了替雷利珠单抗的生物制品许可申请(BLA),作为既往全身治疗后不可切除复发性局部晚期或转移性ESCC患者的潜在治疗选择[3]。2022年7月,由于与COVID-19相关的旅行限制,该机构无法进行所需的审查,因此推迟了对BLA的审批[4]。
2023年9月,FDA根据Ⅲ期RATIONALE 306研究(NCT03783442)的数据,接受了一项BLA的审查,该BLA寻求批准替雷利珠单抗用于不可切除、复发性、局部晚期或转移性ESCC患者的一线治疗[5]。数据表明,在化疗中加用替雷利珠单抗(N=326)治疗这类ESCC患者的中位总生存期(OS)为17.2个月(95%CI:15.8~20.1),而安慰剂加化疗组为10.6个月(95%CI:9.3~12.1)(N=323;分层HR:0.66;95%CI:0.54~0.80;P<0.0001)[6]。
2024年2月,FDA接受了一项BLA的审查,该BLA寻求批准该药物联合含氟嘧啶和含铂类的化疗用于局部晚期不可切除或转移性胃或胃食管交界处腺癌患者的一线治疗[7]。该申请获得了Ⅲ期RATIONALE 305研究(NCT03777657)结果的支持,其中替雷利珠单抗联合化疗的中位OS(N=501)为15.0个月(95%CI:13.6~16.5),而安慰剂联合化疗组为12.9个月(95%CI:12.1~14.1)(N=496;HR:0.80;95%CI:0.70~0.92;P=0.0011)[8]。目标获批日期预计为2024年12月。
参考文献
1.BeiGene receives FDA approval for Tevimbra for the treatment of advanced or metastatic esophageal squamous cell carcinoma after prior chemotherapy. News release. BeiGene, Ltd. March 14, 2024. Accessed March 14, 2024. https://ir.beigene.com/news/beigene-receives-fda-approval-for-tevimbra-for-the-treatment-of-advanced-or-metastatic-esophageal-squamous/20eb032c-15ce-456a-a852-39c88a28d811/
2.Shen L, Kato K, Kim S-B, et al. RATIONALE 302: randomized, phase 3 study of tislelizumab versus chemotherapy as second-line treatment for advanced unresectable/metastatic esophageal squamous cell carcinoma.?J Clin Oncol. 2021;39(suppl 15):4012. doi:10.1200/JCO.2021.39.15_suppl.4012
3.BeiGene announces US FDA acceptance of biologics license application for tislelizumab in esophageal squamous cell carcinoma. News release. BeiGene, Ltd. September 13, 2021. Accessed March 14, 2024. https://hkexir.beigene.com/news/beigene-announces-u-s-fda-acceptance-of-biologics-license-application-for-tislelizumab-in-esophageal-squamous-cell/5c97c078-8ee7-4a4e-aba3-19d5a9dac715/
4.BeiGene provides regulatory update on the US biologics license application (BLA) for PD-1 inhibitor tislelizumab in 2L ESCC. News release. BeiGene. July 14, 2022. Accessed March 14, 2024. https://ir.beigene.com/news/beigene-provides-regulatory-update-on-the-u-s-biologics-license-application-bla-for-pd-1-inhibitor-tislelizumab/09127f95-fd94-4a1b-b215-3e356e5fcfd9/
5.BeiGene announces positive regulatory updates in Europe and the US after recently regaining global rights for Tevimbra. News release. BeiGene, Ltd. September 19, 2023. Accessed March 14, 2024. https://ir.beigene.com/news/beigene-announces-positive-regulatory-updates-in-europe-and-the-u-s-after-recently-regaining-global-rights/5e4692d6-d726-4989-a659-49dc97d4d7ed/
6.Xu J, Kato K, Raymond E, et al. Tislelizumab plus chemotherapy versus placebo plus chemotherapy as first-line treatment for advanced or metastatic oesophageal squamous cell carcinoma (RATIONALE-306): a global, randomised, placebo-controlled, phase 3 study.?Lancet Oncol. 2023;24(5):483-495. doi:10.1016/S1470-2045(23)00108-0
7.BeiGene’s biologics license application for Tevimbra (tislelizumab) for first-line gastric or gastroesophageal junction cancers accepted by FDA. News release. BeiGene. February 27, 2024. Accessed March 14, 2024. https://ir.beigene.com/news/beigene-s-biologics-license-application-for-tevimbra-tislelizumab-for-first-line-gastric-or-gastroesophageal-junction-cancers-accepted/4cc83f12-9249-4984-9a2a-c607c8a6e879/
8.Xu RH, Oh DY, Kato K, et al. Tislelizumab plus chemotherapy versus placebo plus chemotherapy as first-line treatment of advanced gastric or gastroesophageal junction adenocarcinoma: final analysis results of the RATIONALE-305 study.Ann Oncol. 2023;34(suppl 2):S1281-S1282. doi:10.1016/S0923-7534(23)X0011-8
链接:http://www.lewenyixue.com/2024/03/29/%e6%96%b0%e8%8d%af%e9%80%9f%e9%80%92%e4%b8%a8fda%e6%89%b9%e5%87%86%e6%9b%bf%e9%9b%b7%e5%88%a9%e7%8f%a0%e5%8d%95%e6%8a%97%e5%8d%95%e8%8d%af%e6%b2%bb%e7%96%97%e5%8c%96%e7%96%97%e5%90%8e%e6%99%9a/





赶快来坐沙发